CAR-T细胞制备流程包括以下几个步骤:
抽取血样,白细胞分离;
在GMP环境下,准备CAR基因,进行CAR基因转导,获取CAR-T细胞
CAR-T细胞扩增,纯化,并进行质量控制检查;
运送回治疗机构,病人先进行淋巴细胞清除化疗,再输注CAR-T;
CAR-T细胞识别并杀伤癌细胞。
CAR-T治疗流程图 [5](原始图来自于NCI-NIH)
CAR-T细胞治疗,彻底改变了血液系统恶性肿瘤的治疗结果。CD19 CAR-T临床适应症主要为难治性大B细胞淋巴瘤、滤泡性淋巴瘤、急性淋巴细胞性白血病等,BCMA CAR-T则针对多发性骨髓瘤。
CAR-T总体反应率在52-85%,完全应答率达到33-59%[5-7],优于单克隆抗体药物(如Tafasitamab)、小分子抑制剂(如Selinexor)、ADC药物(如Polatuzumab vedotin)等。
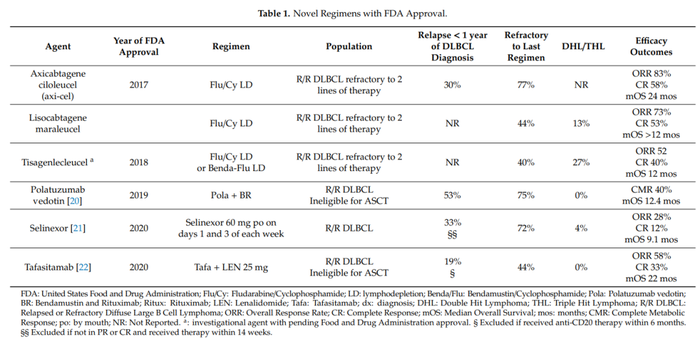
FDA新批准大B细胞淋巴瘤治疗药物(Int. J. Mol. Sci. 2020, 21, 8553)
目前FDA已经批准了六款CAR-T细胞治疗产品,具体数据参考下表。
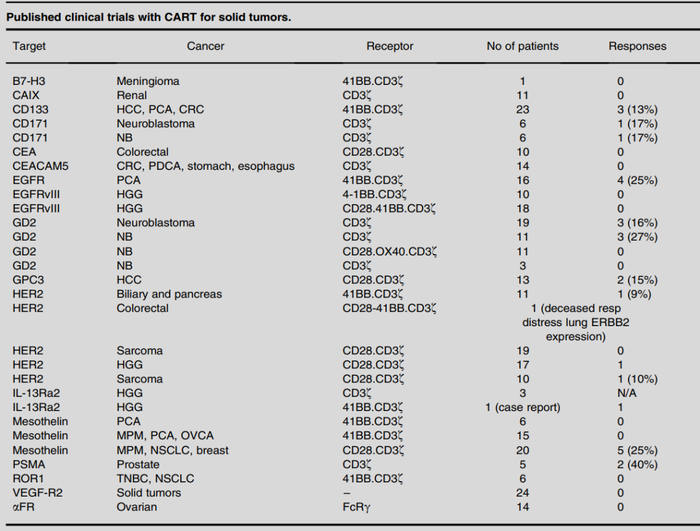
针对实体瘤(如肝细胞癌、胃癌、黑色素瘤、前列腺癌、卵巢癌等),目前虽然进行了数百项CAR-T临床研究,比如Mesothelin(29项),HER2和GD(各26项),GPC3(23项)CEA和CLDN18.2(各10项),除去CLDN18.2(科济CT041)取得ORR 48%的疗效,其余靶点大多无应答(如下表)。
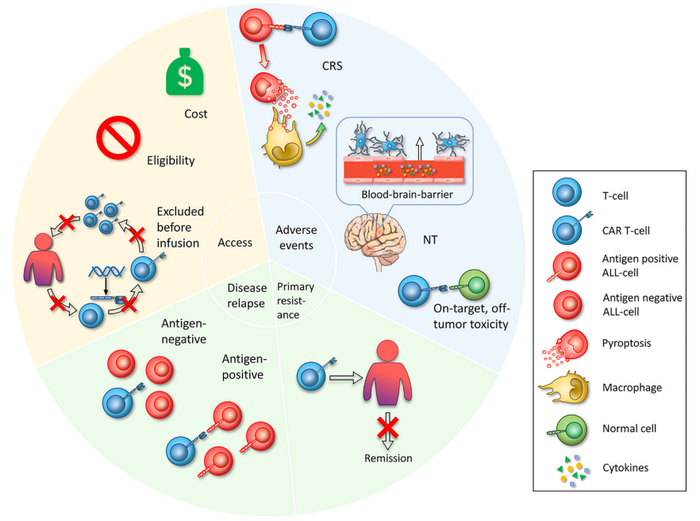
目前CAR-T细胞治疗依然采用个体化生产,产能有限、生产周期长,且成本高昂,影响患者可及性。
收费高昂,超出了大多数患者的支付能力;
病人分离的白细胞质量可能达不到CAR-T生产的标准;
-
CAR-T生产周期长,病人疾病进展可能较快,无法及时获得CAR-T细胞疗法。
CAR-T作为免疫治疗产品,存在免疫相关一些副作用,包括细胞因子风暴(CRS)和神经毒性等,如上表统计CRS发生率达到80-90%,神经毒性发生率达到18-64%[5-7]。此外,脱靶毒性等也是不能忽略的问题。
部分肿瘤细胞对于CAR-T治疗不敏感,无法产生消退。
长时间看,细胞治疗产生消退的患者,如多发性骨髓瘤50%以上会复发(无进展生存期小于12个月)[7]。产生的机制多样,比如肿瘤细胞通过突变靶抗原,对CAR-T细胞治疗产生获得性耐药。比如2021年在Abecma(idecabtagene vicleucel; ide-cel)获批后不久,BMS、蓝鸟和丹娜法伯癌症研究院(Dana Farber Cancer Institute)联合在Nature communications发表文章[9],阐述了BCMA CAR-T一种耐药机制: 即BCMA双等位基因丢失。
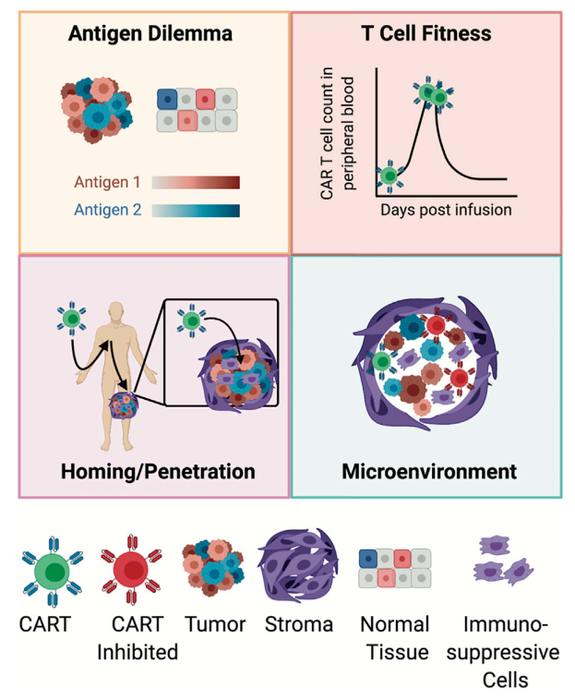
如在适应症和临床现状中讨论,目前CAR-T治疗实体瘤,应答率和有效率都极低,可以概括为基本无效。非常多的文章讨论过相关机制,比如缺乏特异性肿瘤相关抗原,物理屏障阻隔CAR-T穿透入实体瘤内部,恶劣的肿瘤微环境诱导CAR-T功能耗竭等。
除了以上挑战之外,CAR-T细胞的质量控制,临床前试验模型的缺乏等也是研发和临床申报中广泛面临的问题。(
更多内容参见文末
)
如五大挑战部分所阐述,目前获批上市CAR-T均是个体化治疗产品,而个体化方案是限制可及性的主要因素。很多企业正在寻求现货型(off-the-shelf)CAR-T来解决这一难题,在目前来看这是有效的突破方向。
现货型CAR-T的优势:
可提前制备,直接使用;
可批量生产,降低成本;
-
宿主同种异体T细胞识别未修饰T细胞上不匹配的人类白细胞抗原(HLAs),引起排斥反应。一些宿主NK细胞也可能感觉到不匹配的T细胞上某些宿主HLAI类分子的缺乏,促进排斥。现货型CAR-T通过主要开发逻辑是阻断移植排斥反应。常用的策略包括:
敲除引起移植排斥反应的HLA分子;过表达HLA-E/G或CD47;在现货型CAR-T细胞上保留HLA-C和非经典的HLAI类分子;主动的方法可以通过非选择性抑制宿主免疫(清除宿主淋巴细胞,包括CD52/CD38单克隆抗体和FOLFOX);选择性消除激活的同种异体反应性淋巴细胞。
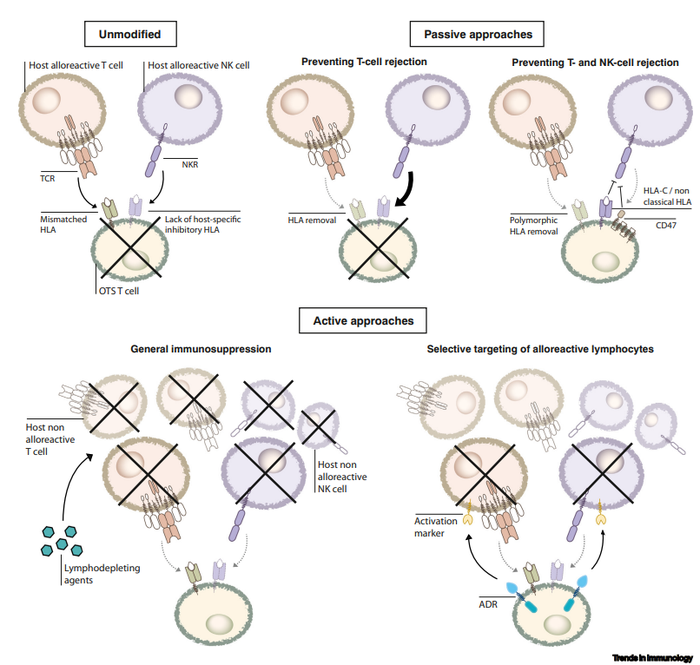
但现货型CAR-T,基因敲除可能会引起T细胞染色体异常[12],存在安全性问题,该技术的先驱Cellectis和Allogene多次被叫停临床研究。
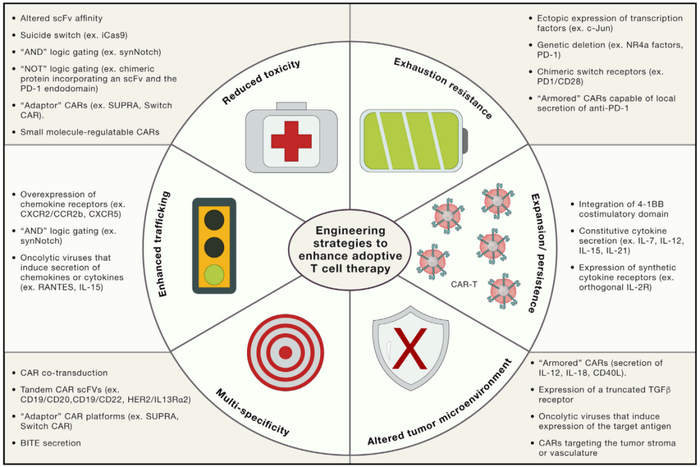
CAR基因工程策略 [13]
现在的策略包括,改变scFv的亲和力,自杀开关,逻辑开关(减少off-target),适配体CARs(减少off-target),小分子调节CARs(小分子作为调节开关等)。
现在的策略包括,敲除免疫检查点分子;利用抑制转激活受体,将抑制信号转为激活信号;表达存活基因;武装分泌PD-1抗体基因。
基因工程增加共刺激分子;增加细胞因子分泌(IL-7,IL-12等);增加细胞因子受体表达等。
武装CAR分泌IL-12等细胞因子;表达截断的TGF-β受体;溶瘤病毒增加靶抗原;将抑制信号转为激活信号的受体。
多特异性CAR有助于解决肿瘤细胞获得性耐药的问题。
比如增加特异性趋化因子受体的表达,武装多个识别肿瘤及细胞外机制等的scFv等,增加CAR-T向实体瘤局部迁移。
除了CAR-T之外,使用CAR武装另外一个免疫效应细胞(NK细胞)也成为研究热点。CAR-NK有多种优势,比如对移植排斥反应天然抵抗,可以使用脐带血干细胞分化产生NK细胞,因而天然具有现货型CAR细胞的特征;体内半衰期短,可以降低毒副作用的考量。不过,现在只有30多个临床开展,还没有获得令人振奋的临床结果,开发尚需时间。
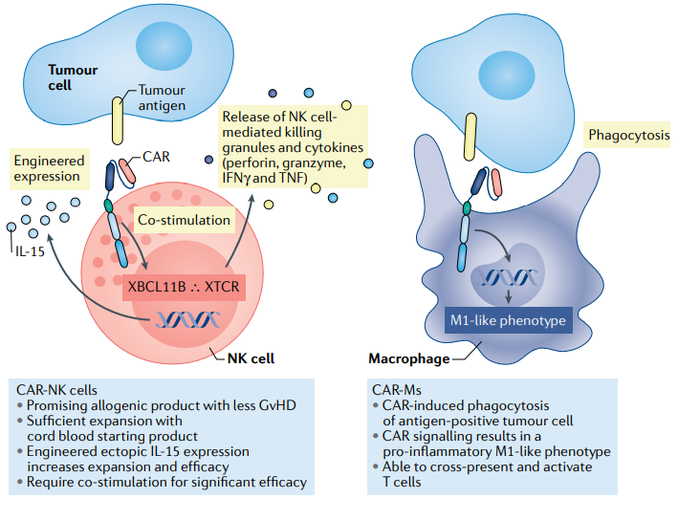
CAR-M巨噬细胞是抗原递呈细胞,CAR-M增加抗原递呈能力,激活体内的T细胞,从而发挥抗肿瘤活性。但其临床有效性也同样需要时间来检验。
无论是CAR 基因改造还是在多种CAR细胞中寻找最优答案,都对操作环境、设备及操作符合规范的要求尤其严格。Eppendorf 系列产品不仅可以实现 CAR-T 细胞产品研发生产中的安全性、质量可控性、产品工艺一致性及数据合规性,更有高效节能和用户友好的特点。
细胞治疗产品从IND到BLA过程中的数字化战略(网络讲座)
CAR-T在血液肿瘤惊艳的表现,让CAR-T无疑成为人类攻克癌症的重要武器。
针对CMC研发生产的诸多困境,学术界和产业界同样尝试了不同的策略,在通过现货型CAR-T降低成本,增加可及性,通过基因工程改造CAR增加实体瘤穿透性的尝试中,Eppendorf 将与您携手共同探索发展与未来。
1.https://s21.q4cdn.com/104148044/files/doc_financials/quarterly_reports/2022/BMY-Q22022-Earnings-Press-Release.pdf
2.https://www.novartis.com/sites/novartis_com/files/q2-2022-media-release-en.pdf
3.https://s29.q4cdn.com/585078350/files/doc_financials/2022/q2/Gilead-Sciences-Q222-Earnings-Press-Release-2-August-2022.pdf
4.https://www1.hkexnews.hk/listedco/listconews/sehk/2022/0721/2022072101231_c.pdf
5.Crees, Z.D.; Ghobadi, A. Cellular Therapy Updates in B-Cell Lymphoma: The State of the CAR-T. Cancers 2021, 13, 5181
6.Nikhil C. Munshi et al, Idecabtagene Vicleucel in Relapsed and Refractory Multiple Myeloma, N Engl J Med . 2021 Feb 25;384(8):705-716.
7.Jesus G Berdeja et al,Ciltacabtagene autoleucel, a B-cell maturation antigen directed chimeric antigen receptor T-cell therapy in patients with relapsed or refractory multiple myeloma (CARTITUDE-1): a phase 1b/2 open-label study,Lancet 2021; 398: 314–24
8.Victor Moreno et al,Adoptive cell therapy for solid tumors: Chimeric antigen receptor T cells and beyond,Current Opinion in Pharmacology 2021, 59:70–84
9.Mehmet Kemal Samur et al,Biallelic loss of BCMA as a resistance mechanism to CAR T cell therapy in a patient with multiple myeloma,NATURE COMMUNICATIONS | (2021) 12:868 | https://doi.org/10.1038/s41467-021-21177-5
10.Xu X, Huang S, Xiao X, Sun Q, Liang X, Chen S, Zhao Z, Huo Z, Tu S and Li Y (2021) Challenges and Clinical Strategies of CAR T-Cell Therapy for Acute Lymphoblastic Leukemia: Overview and Developments. Front. Immunol. 11:569117
11.Feiyan Mo et al, Taking T-Cell Oncotherapy Off-the-Shelf, Trends Immunol. 2021 Mar;42(3):261-272.
12.Nahmad, A.D., Reuveni, E., Goldschmidt, E. et al. Frequent aneuploidy in primary human T cells after CRISPR–Cas9 cleavage. Nat Biotechnol (2022). https://doi.org/10.1038/s41587-022-01377-0
13.Evan W Weber et al, The Emerging Landscape of Immune Cell Therapies, Cell. 2020 Apr 2;181(1):46-62.
14.Larson RC, Maus MV.Recent advances and discoveries in the mechanisms and functions of CAR T cells, Nat Rev Cancer . 2021 Mar;21(3):145-161.























评论
加载更多