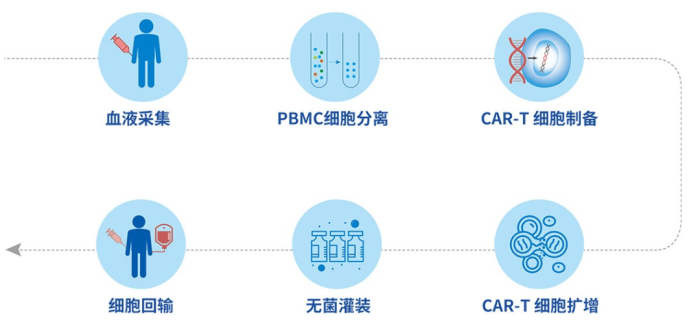
CAR-T细胞生产工艺中的关键环节有哪些?如何规模化、安全稳定的生产制备?
面对如此巨大的市场,药企们也在加速布局,临床进展不断提速。数据显示,全球在clinicaltrials.gov上注册的CAR-T临床项目已达700多项。纵观国内,累计有近40款CAR-T疗法正在研发中。随着越来越多的CAR-T产品即将步入临床,如何快速规模化地进行相对“个性化”的生产制备,并保证产品安全性和质量稳定性,是大家面临的一大挑战。
CAR-T细胞生产过程包括T细胞的富集和分离、CAR-T细胞的制备和终产品的低温贮藏。其中制备过程包括T细胞在体外的激活与扩增、CAR基因的转导、CAR-T细胞的扩增等步骤。本文简要概述CAR的基因转导与CAR-T细胞培养这两个关键环节。
1
关键环节一:CAR基因转导
在基因转导环节,CAR的结构设计、基因转导方式、转导效率等都是关键的影响因素。
自本世纪初,人们一直致力于修饰、改造CAR-T结构的胞内信号转导区,根据“共刺激分子序列”结构的不同,CAR-T 细胞可分以下五代:
第一代CAR-T仅有胞外结构域、跨膜结构域和胞内信号转导结构域组成,诱导T细胞激活仅通过CD3ζ信号域激活,缺少共刺激信号,细胞活性和效力很弱,需要外源性给予细胞因子;
第二代CAR-T中增加了一个4-1BB、或CD28、或OX40分子共刺激结构域,增强来自TCR-CD3的信号,细胞增殖能力和杀伤毒性都大大的增加,目前大多数产品使用的是二代CAR结构,如:诺华的Kymriah和吉利德的Yescarta;
第三代CAR-T增加了两个或更多共刺激结构域,以提高CAR-T的活性和效力。但是第三代的临床表现并不优于第二代CAR-T;
第四代CAR-T在二代的基础上可表达特定的细胞因子(IL-2、IL-12、IL-15等),克服了肿瘤免疫微环境的抑制,通过修饰肿瘤微环境募集并活化其他免疫细胞进行免疫反应,进一步增强对肿瘤的杀伤作用;
第五代通用型CAR-T敲除异体T细胞上的TCR(T细胞抗原受体)、MHC以及相关信号通路基因,以避免异体型CAR-T细胞的宿主排斥反应。
目前,主要有两种病毒载体用于CAR-T细胞基因转导:γ逆转录病毒载体和慢病毒载体。其中慢病毒载体在科研和临床开发中越来越受到青睐,主要因其具备以下优势:
慢病毒更安全,更低的致癌转化和随机转基因整合风险;
应用范围更广,可转导分裂/非分裂细胞;可以转导多种细胞,包括难以转导的造血前体细胞、神经元细胞、淋巴细胞和巨噬细胞等;
慢病毒转基因负荷量更大,可容纳6.5kb的外源基因且基因毒性更小;
慢病毒介导的基因表达持续且稳定,并随细胞基因组的分裂而分裂;
慢病毒生产成本较低;
慢病毒的转导效率接近100%,高于γ逆转录病毒。
作为递送基因的载体工具,高质量的慢病毒产品是CAR-T细胞药物有效性及安全性的保证,因此其慢病毒产品的质量表征是关键。临床试验中要求准确调整病毒载体剂量和细胞转导效率,并对最终产品进行严格的质量控制以保证其安全性。
目前慢病毒最精确滴度测量方法是,感染细胞后,使用qPCR来检测整合到靶细胞基因组中的前病毒拷贝数。这种方法可以区分多个整合事件,减少低估病毒滴度的可能性。此方法的主要缺点是工作量较大,需要用病毒制剂的连续稀释液转化靶细胞,分离基因组DNA,并使用针对病毒成分或转基因本身的引物来量化整合事件的数量。
表征细胞感染效率的关键参数是感染复数(MOI),即感染时病毒与细胞数量的比值。理论上MOI值越大,感染效率越高,但对细胞的毒性也越大,适宜的MOI值是高感染效率的关键因素之一。慢病毒的感染能力随细胞类型的不同而不同,因此每种不同的细胞类型需要不同的MOI。理想情况下,MOI与感染细胞数量之间应呈线性关系。
然而由于病毒结构的复杂性,慢病毒产品的质控也很重要。慢病毒GMP生产的一些特异性检测包括评估慢病毒载体的纯度与特性,如蛋白质和DNA污染物;形态和基因组完整性;安全性,如可复制型慢病毒、外源性病原体,支原体,内毒素/热原;病毒效力,如总/活性慢病毒颗粒;以及最终批次的其他理化性质,如pH、渗透压、电导率。慢病毒规模化生产的产能、成本、质量等各方面都将直接影响着CAR-T产品最终的治疗应用。
2
关键环节二:CAR-T细胞扩增培养
在 CAR-T 治疗过程中,需将经过技术改造的 T 细胞进行体外培养,达到符合治疗要求的细胞数量后,再回输到病人体内靶向杀死癌细胞。在CAR-T生产中,补充细胞因子以增强体外CAR-T细胞的增殖是一种常见的做法。IL-2可诱导T细胞扩增,通过调节IL-2浓度,可以增加早期记忆细胞数量。
另外,CAR-T细胞扩增还需要重点考虑如何保持CD4+和CD8+T细胞的平衡。而且,非转导的T细胞在有外源刺激因子刺激时也可以扩增。扩增时间受限于技术和培养体系的选择,通常需要1-2周。目前T细胞体外快速扩增仍然是一个挑战,即使有细胞因子的参与,扩增的速度和稳定性仍然需要进一步的探索和优化才能实现。
目前,绝大部分企业的CAR-T细胞制备仍旧是纯手动化生产,这样的生产方式不仅导致产品被污染的风险增加,而且容易产生产品批次间差异。另外,CAR-T的生产过程需由B级条件下的生物安全柜保障全过程的无菌性,因此对生产人员的无菌操作提出了极高的要求。CAR-T细胞产品一旦被细菌污染,现有技术都无法对其进行除菌,因此,监管部门对细胞治疗产品的GMP生产有着特别严格的环境清洁度和操作要求。环境监测必须严格验证,实时监测。而且,CAR-T细胞疗法是一种自体产品,不同患者的细胞之间应当避免交叉污染。
根据我国首个《CAR-T细胞制剂制备质量管理规范》,CAR-T细胞产品在生产时的每一个环节都应严格遵循临床要求。
总之,CAR-T细胞产品作为“活的”药品,与传统生物制品相比,其在生产工艺、质量研究、质量控制、放行检测和稳定性研究等方面均需要特殊考量,因此面临的挑战更大,需要更加全面和充分的分析方法来保证CAR-T细胞质量控制方法的稳定性和高效性。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多