解析|单克隆抗体制备实验过程
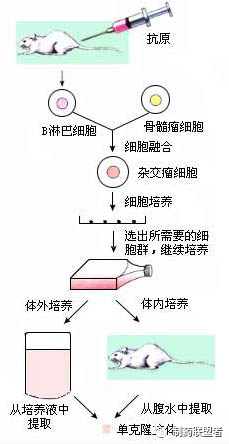
一、 免疫动物
免疫动物是用目的抗原免疫小鼠,使小鼠产生致敏B淋巴细胞的过程。一般选用6-8周龄雌性Balb/c小鼠,按照预先制定的免疫方案进行免疫注射。抗原通过血液循环或淋巴循环进入外周免疫器官,刺激相应B淋巴细胞克隆,使其活化、增殖,并分化成为致敏B淋巴细胞。
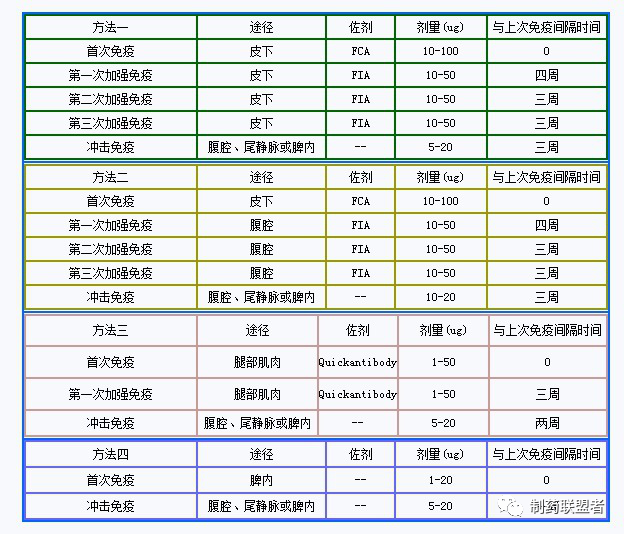
说明:FCA,弗氏完全佐剂;FIA,弗氏不完全佐剂;Quickantibody,北京康碧泉公司研制的佐剂。上表中第四种免疫方法产生的抗体大部份都为IgM,存在亲和力弱等缺点,慎用。
PS:1、一般皮下注射每个注射点注射30-50ul左右混有佐剂的抗原,每只小鼠注射6-8个点为宜。
2、腹腔注射时,如果抗原混有弗氏佐剂,建议注射在左侧腹腔,如果采用右侧腹腔注射,则在免疫过程中,很容易导致小鼠脾脏与腹膜粘连的情况,造成后期取出脾脏麻烦。
3、冲击免疫完成后,应在96小时内完成细胞融合,否则相应的B细胞数量会下降到未冲击前的水平。
二、细胞融合 (Cell fusion)
【材料和试剂】
(1)骨髓瘤细胞悬液 选好骨髓瘤细胞株,取体外培养对数生长期细胞或体内生长的肿瘤分离骨髓瘤细胞,制备细胞悬液。
(2)免疫小鼠脾细胞悬液 取3天前加强免疫的小鼠,眼眶放血,分离血清冻存备用。拉颈处死小鼠,浸泡于75%酒精中3~5min。无菌操作取出脾脏,置入盛有5ml不完全培养液的平皿中洗涤,剪去周围的结缔组织,将脾脏移入另一盛有5ml不完全培养液的平皿中的钢网上,先用剪刀剪成3~5个小块,然后用注射器内芯研磨。将脾脏细胞悬液移至50ml离心管中,加不完全培养液50ml,1000r/min离心5min,弃上清,再以同法洗涤离心一次。然后将沉淀细胞重新悬浮于10ml不完全培养液中,计活细胞数,一般一只小鼠可得0.5~2×108 个脾细胞。
(3)饲养细胞 将小鼠致死、体表消毒和固定后,用消毒剪镊从后腹掀起腹部皮肤,暴露腹膜。用酒精棉球擦拭腹膜消毒。用注射器注射10ml不完全培养基至腹腔,注意避免穿入肠管。右手固定注射器,使针头留置在腹腔内,左手持酒精棉球轻轻按摩腹部1分钟,随后吸出注入的培养液。1000r/min离心5-10分钟,弃上清。先用5ml HAT培养基将沉淀细胞悬浮,根据细胞计数结果,补加HAT培养基,使细胞浓度为2×105/ml,备用。
(4)主要试剂的配制
①细胞培养基杂交瘤技术中使用的细胞培养基主要有RPMI-1640或DMEM(Dulberco Modified Eagles Medium)两种基础培养基,配好后过滤除菌(0.22um),分装,4℃保存。
不完全RPMI-1640培养基:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
不完全DMEM培养基:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
用1N HCl调试PH至7.2-7.4,过滤除菌,分装4℃保存。
完全RPMI-1640或DMEM培养基:
|
|
|
|
|
|
HT或HAT培养基:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
②氨基喋呤(A)贮存液(100×,4×10-5mol/L)
称取1.76mg氨基喋呤(Aminopterin MW 440.4),溶于90ml超纯水或四蒸水中,滴加1mol/L NaOH 0.5ml中和,再补加超纯水或四蒸水至100ml。过滤除菌,分装小瓶(2ml/瓶),-20℃保存。
③次黄嘌呤和胸腺嘧啶核苷(HT)贮存液(100×,H:10-2mol/L,T:1.6×10-3mol/L)
称取136.1mg次黄嘌呤(Hypoxanthine,MW 136.1)和38.8mg胸腺嘧啶核苷(Thymidine,MW 242.2),加超纯水或四蒸水至100ml,置45-50℃水浴中使完全溶解,过滤除菌,分装小瓶(2ml/瓶),-20℃冻存。用前可置37℃加温助溶。④L-谷氨酰胺(L.G.)溶液(100×,0.2mol/L)
称取2.92g L-谷氨酰胺(L-glutamine,MW 146.15),用100ml不完全培养液或超纯水(或四蒸水)溶解,过滤除菌,分装小瓶(4-5ml/瓶),-20℃冻存。
⑤青、链霉素(双抗)溶液(100×)
取青霉素G(钠盐)100万单位和链霉素(硫酸盐)1g,溶于100ml灭菌超纯水或四蒸水中,分装小瓶(4-5ml/瓶),-20℃冻存。
⑥7.5% NaHCO3溶液
称取分析纯NaHCO3 7.5g,溶于100ml超纯水或四蒸水中,过滤除菌,分装小瓶(4-5ml/瓶),盖紧瓶塞,4℃保存。
⑦HEPES溶液(1mol/L)
称取23.83g HEPES(N-2-Hydroxyethylpiperazine-N,-2-ethanesulfonic acid,N-2-羟乙基哌嗪- N,-2-乙基磺酸,MW 238.3)溶于100ml超纯水或四蒸水中,过滤除菌,分装小瓶(4-5ml/瓶),4℃保存。
⑧8-氮鸟嘌呤贮存液(100×)
称取200mg 8-氮鸟嘌呤(8-azaguanine,MW 152.1),加入4mol/L NaOH 1ml,待其溶解后,加入超纯水或四蒸水99ml,过滤除菌;分装小瓶,-20℃冻存。使用时按1%浓度加入到培养液中(即终浓度为20ug/ml)。
⑨50% PEG
称取PEG 1000 或4000 20-50g于三角瓶中,盖紧,60-80℃水浴融化,0.6ml分装于青霉素小瓶中,盖紧,8磅高压蒸汽15分钟,-20℃存放备用。临用前加热融化,加等量不完全培养基,用少许7.5% NaHCO3调PH至8.0,或购买Sigma或Gibco公司现成产品。
(5)24孔及96孔培养板等细胞培养所用材料和试剂。
【操作步骤】
PS:1、冻存的骨髓瘤细胞在复苏后要2周时间才能处于适合于融合的状态,培养目标是使处于对数生长的时间尽可能长。
2、饲养层细胞应在使的前一天制备好,这样才能分泌足够的细胞因子。
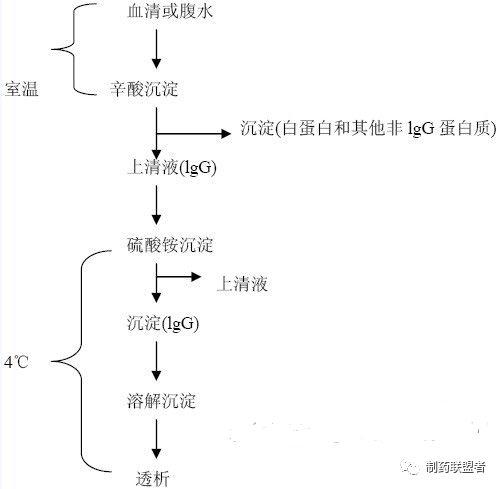
2、方法
(1) 将腹水用0.06 M醋酸钠(pH4.0)按1:3稀释,用1mol/L NaOH 调至血清稀释液为pH4.5。
(2)室温下边搅拌(磁力搅拌器 或电功搅拌器),边缓慢滴加辛酸(一般按每毫升稀释前的腹水加入40 ul正辛酸),滴加完后继续搅拌30min。
(3)4 ℃ 静置2 h。
(4)4 ℃10000 g离心20min,可见辛酸因温度低而从系统中结晶析出漂浮在腹水上层,用多层纱布过滤,弃去此结晶以及底部沉淀,收集上清夜。
(5)向上清中加入1/10体积的10×PBS(0.1M,pH 7.4)。
(6)4 ℃条件下,向其中加入饱和硫酸铵溶液,使终浓度为45%饱和度,静置1h以上。
(7)10000 g离心10-20min;弃上清,将沉淀溶于适量1×PBS中,再将其装入透析袋用10mM的tris或PBS透析(透析液应为抗体体积的100倍以上,最好搅拌),4 ℃过夜。
(8)收集透析好的抗体,直接现用或加入保护剂和防腐剂长期保存(-20℃保存或冻干保存)。
用这种方法纯化出来的抗体纯度可达80-90%左右,损失较少,对抗体的活性损失也较少,试剂成本低,但是操作比较费时。
3、蛋白含量测定
紫外分光光度法测样品在波长260nm,280nm处的I及收光度(A 260, A 280),蛋白含量按以下公式计算蛋白量(g/L)=(1.45 ×A280 -0.74× A 260)×稀释倍数
注:
1、单抗制备(小鼠)中的杂交瘤细胞是半贴壁型的细胞。
4、为防止细胞污染,通常用的抗生素有青霉素(100 U/ml)和链霉素(100 ug/ml)、四环素(50 ug/ml)、庆大霉素(50 ug/ml),其中青霉素和链霉素联合使用较为常用,俗称“双抗”。
5、取少量分装的培养基加入至液体LB培养基里37 ℃培养过夜进行无菌测试(其它4 ℃保存),确认培养基无菌后才能使用。
6、LB培养基的配制:胰蛋白胨(tryptone) 10g 酵母提取物(yeast extract) 5g 氯化钠(NaCl) 10g 固体培养基另加琼脂粉 15-20g 加双蒸水至1000mL, 用5mol/L NaOH(约0.2ml)调pH至7.2,121℃灭菌30min。
7、融合所用的瘤细胞是选择出来的次黄嘌呤磷酸核糖转移酶(Hypoxanthine guznine phosphoribosyl transferase,HGPRT)和胸腺嘧啶激酶(thymidine kinase,TK)缺陷细胞株,从而能有效地阻断瘤细胞DNA合成的外源性途径。
8、在瘤细胞利用磷酸核糖、氨基酸、CO2和NH3等化合物合成核苷酸过程中,叶酸是重要的辅酶,而氨甲蝶呤是叶酸的拮抗剂,可阻断瘤细胞DNA合成的内源性途径。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多