生物制剂和疫苗制剂开发中的辅料选择
随着蛋白质治疗剂和疫苗的不断发展,加工和储存期间的稳定性对制药业提出了重大挑战。生物制剂和疫苗天生就不稳定,易于在生产储存条件下通过物理和化学降解机制降解。因此,在加工和储存过程中需要多种赋形剂或者保护剂来稳定生物制剂和疫苗。选择和使用合适的赋形剂、保护剂可以开发新的疗法和强大的药物产品。本文概述了与生物制剂和疫苗制剂开发相关的挑战,以及用于稳定这些产品的不同类型的赋形剂。
辅料
从定义上讲,赋形剂、保护剂本身就是一种药理学惰性物质,但是与活性成分结合使用时,它可以提供多种好处。赋形剂或保护剂在药品中的使用可以追溯到中世纪,当时赋形剂主要用作活性成分或调味剂的载体,以改善药物的适口性。在当今的药物开发中,赋形剂、保护剂是药物产品不可或缺的一部分,以多种方式使用,并且具有明确定义的功能角色。对于蛋白质和疫苗,这些作用包括:
(a)增强活性成分的溶解度
(b)增强活性成分的过程和保质期稳定性
(c)控制pH和缓冲液表面张力
(d)维持蛋白质或疫苗的最佳稳定构象,包括功能表位的暴露。主要用于疫苗的另一类赋形剂是佐剂,其定义为增强药物药理作用或增加抗原刺激免疫系统能力的物质。
赋形剂、保护剂被批准为药物产品的一部分,但并非单独获得批准。它们的范围从充分表征的有机或无机分子到更复杂且难以表征的生物结构。赋形剂、保护剂的选择还取决于各个市场的法规要求。在美国,美国食品药品监督管理局(FDA)在数据库(IID)中提供了可搜索的已批准无效成分列表及其批准的浓度,剂型和给药途径。在日本,日本药物赋形剂理事会(JPEC)在《日本药物赋形剂词典》(JPED)中将赋形剂制成批准的产品,给药途径和患者可接受剂量。在加拿大,加拿大卫生部发布了可接受的非药物制剂清单。但是,欧洲药品管理局没有在欧洲批准的药品中列出赋形剂、保护剂的等效清单或数据库。
一般公认的安全(GRAS)赋形剂保护剂
来自食品工业的赋形剂通常具有美国FDA公认的安全(GRAS)认证。指定为GRAS的辅料的人体暴露水平和安全性信息已经被允许使用。必须注意的是,即使疫苗和生物制剂广泛筛选了GRAS赋形剂,但肠胃外的给药途径也限制了可用的赋形剂或保护剂。表1提供了生物制剂和疫苗制剂中常用赋形剂的实例。
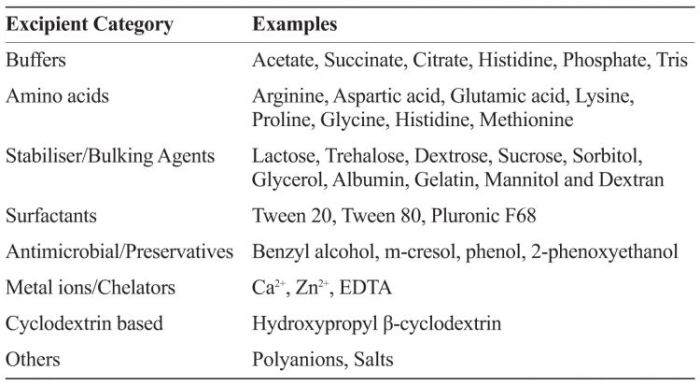
表1:生物制剂和疫苗制剂中一些常用药物赋形剂的类别和实例
新型赋形剂或保护剂
新赋形剂、保护剂被定义为在药物产品中首次使用或通过新的给药途径使用的赋形剂。赋形剂可以是新的化学实体,也可以是尚未在人类产品中使用的完整的化学实体,用于预期的给药途径或拟定水平。国际药物赋形剂理事会(IPEC)是一个国际行业协会,致力于发展和协调国际赋形剂的使用标准,引入新的赋形剂以及开发有关赋形剂的最佳做法和指南。正在研究用于生物制品的一些新型赋形剂是基于环糊精的赋形剂。
生物制剂和疫苗制剂的辅料:生物制剂和疫苗制剂的挑战
生物分子(肽,蛋白质,mAb和疫苗)天然地不如小分子稳定,并且在严格的产品开发时间表上,制剂开发通常具有挑战性。此外,原料药的供应有限,尤其是在早期开发期间,迫使配方科学家严重依赖使用有限分析技术进行的强制降解研究。这样的方法通常导致制剂开发往往不是最佳的选择,最终导致在临床和商业制造期间的稳定性和生产过程中制品的稳定性不佳。此外,复杂的分子结构,缺乏明确的稳定性指示测定法和多种降解机制为生物制剂和疫苗的制剂开发创造了开发的障碍。活性分子-辅料相互作用的研究对于合理设计稳定剂对于蛋白质的治疗药物和疫苗的制剂开发至关重要。制剂开发的复杂性对于高浓度抗体制剂的开发通常更为明显,这是由于生物制品粘度的限制,高浓度下的分析表征以及期望在维持赋形剂与抗体的比例以提供稳定性的同时配制等渗制剂的原因。
疫苗的配方开发面临其他挑战,因为疫苗抗原可以是不同类型,包括减毒活病毒,灭活病毒,纯化的重组蛋白,纯化的病毒蛋白,病毒样颗粒,灭活的细菌毒素和多糖。通常,除佐剂外,疫苗产品中还包含多种抗原。基于肽,蛋白质和亚基的抗原的制剂开发可以以类似于生物制剂的方式进行。但是,减毒活病毒疫苗的制剂开发可能需要不同的方法,因为重点是稳定整个病毒颗粒和相关的感染性。新兴市场的疫苗可以从提高热稳定性的赋形剂中受益。对于室温稳定性,组合产品,多剂量产品以及带有自动注射器或预填充注射器的差异化产品的需求可能会进一步增加挑战。为了确保配方研究者和目标市场之间的完全一致,在计划的早期就以客户为中心,制定针对全球产品的保护剂或赋形剂就非常重要。这将成为配方开发的基础,并确保成功开发出安全,有效和优质的产品。
辅料筛选方法
通常,制剂开发过程可以最少分为三个不同但相互联系的阶段,即预配制,制剂配方摸索和过程开发。配制前阶段包括根据其氨基酸序列了解生物制剂,根据pH,离子强度和赋形剂进行生化和生物物理表征,以了解重要的降解途径。此阶段还涉及开发稳定性指示测定法,以及最好是使用系统性方法(例如实验设计(DOE))鉴定一些主要的赋形剂。使用高通量配制方法可以在存在压力条件(例如pH值)的情况下探测结构(例如,二级,三级等)和功能(例如,活性,效力,可能的结合)的变化,从而获得大分子行为的全面图像。温度,冻融,干燥等条件都会对赋形剂、保护剂的筛选提出挑战。表2提供了在制剂筛选中测试的因素和一般范围的示例。
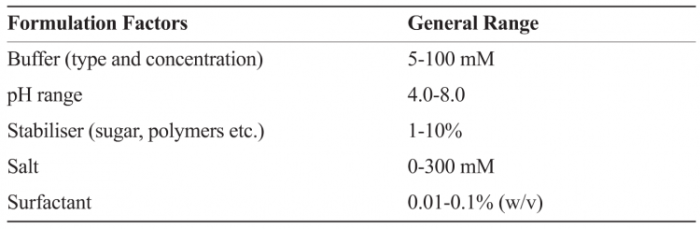
表2:示例说明了确定配方设计空间的因素
如果最初的稳定性研究表明液体制剂不能满足计划初期确定的产品要求,则可以开始开发冷冻或冻干产品。这种合理的预配方方法还可以逐步推进配方开发过程中采用QbD(按设计质量)方法提供基础。通过广泛的稳定性研究(普通和加速)和体内动物模型测试(适用时),必须为临床前和临床生产选择潜在的制剂。必须指出,体内检测可能与人体免疫原性相关或不相关,并且通常用作重要指标检查。在临床开发期间重新制定配方或重新处理可能需要进行临床桥接研究,从而增加了程序的成本和复杂性。因此,建议尽早进行制剂处方工艺和配方优化。
液体配方开发
对赋形剂稳定生物制剂方式的作用机制理解对于成功的制剂选择策略至关重要。可以通过适当选择赋形剂来靶向影响分子构象稳定性作用力,例如静电相互作用,范德华相互作用,氢键和疏水性。例如,可以优先从蛋白质表面排除,高浓度的糖类(如蔗糖,海藻糖,乳糖等)以及多元醇(如山梨糖醇,甘露醇,聚乙二醇等)可稳定生物制剂的天然构象,从而提供制剂的稳定性。必须指出的是,由于水表面张力的增加,排除了蔗糖,疏油效果排除甘油,由于空间干扰排除聚乙二醇。类似地,通常可以通过添加适度的盐来增加蛋白质的溶解度,这种现象称为“盐化”。盐也用作张力调节剂;但是,在某些情况下,它可能会对构象稳定性产生负面影响。因此,制剂中离子的选择及其浓度可用于更改生物制剂的稳定性。在配制前筛选期间,这被认为是至关重要的。例如,可以在不同的组成下(即在不同的离子强度下)使用不同的缓冲液种类来获得相同的pH条件,因此可以改变蛋白质的稳定性。配体的结合也可以促进蛋白质的天然状态,例如Zn2+与人类生长激素的结合。
通常添加表面活性剂可以抑制蛋白质(空气-水和固体-水)在界面(空气-水和固体-水)上的吸附,变性或聚集,并且还可能通过与蛋白质的天然或变性状态的差异结合而影响稳定性。研究者经常使用搅动或冻融应力研究来说明表面变性现象,添加低浓度的表面活性剂(例如聚山梨酯20,聚山梨酯80,PluronicF68或其他)可能有效地减少可溶和不可溶聚集体。由于在选择赋形剂或保护剂时需要解决主要接触表面的问题,因此还需要考虑渗滤液,例如金属离子,玻璃小瓶中的钡,塞子中的硫化剂,预填充注射器中的氧化钨以及暴露于硅油中的离子。例如,EDTA可用于处理来自塞子的金属浸出液。因此,深入了解蛋白质的主要降解机理以及使用配体和共溶质来增强其构象稳定性可以帮助缩小用于制剂开发的赋形剂的选择范围。
大约有三分之一的生物产品可以多剂量形式获得,这些通常需要添加抗微生物防腐剂。防腐剂可通过诱导蛋白质聚集为生物制品带来其他稳定性挑战。常用的防腐剂包括间甲酚,苯甲醇或苯酚,苯氧乙醇和氯丁醇。建议在选择之前单独或组合筛选各种防腐剂。对于多剂量制剂,水溶液条件下蛋白质的不稳定性可能会导致冻干剂型稳定性的不确定性,从而影响没有防腐剂和BWFI(注射用抑菌水)的重构。
冻干制剂开发
为了制品更加稳定,在储存和运输要求与目标产品特性保持一致,使得冻干成为液体制剂的合适替代品,特别是对于高度不耐热的产品和活病毒疫苗产品。冻干过程包括冷冻,然后在真空下进行初次和二次干燥。干燥过程本身也带来了其他挑战。例如,在冷冻期间,变性可以冷冻浓缩制品状态,在冷冻表面界面处或通过冷冻引起变性的发生。因此,配方研究者必须考虑到盐和缓冲液的局部浓度的影响,以及在冷冻浓缩状态期间氧气浓度的增加。同样,在冻干产品的配方设计期间,必须考虑由于缓冲剂结晶引起的pH值变化。例如,与磷酸钠缓冲液相比,优选在生理pH条件下用低浓度(≤10mM)的磷酸钾缓冲液进行冻干。这归因于pH值随缓冲液浓度的增加而变化,并且在冷冻过程中磷酸钠的pH值变化较大。如果在适当的pH范围内,柠檬酸盐,Tris和组氨酸是缓冲液的良好选择,因为在冷冻过程中pH值变化最小。同样,可以添加抗氧化剂(例如抗坏血酸)和清除剂(例如硫脲)以限制制品的氧化。
除了防冻剂外,可能还需要其他被称为冻干剂的稳定剂。例如,液体预制剂筛选可能表明山梨糖醇是一种良好的稳定剂。然而,由于山梨糖醇的玻璃化转变温度低,因此在冻干制剂中不是最优选的。必须注意的是,高的玻璃化转变温度可最大程度地降低分子的迁移率,同时通过充当良好的“水代用品”(例如蔗糖,海藻糖)而保持干燥状态下的自然状态是冻干保护剂的两个关键属性。此外,在风险评估策略中必须明确权衡使用还原糖(例如乳糖)的情况。但是,相分离的可能性(特别是对于多稳定剂系统而言)可能会限制赋形剂(例如PEG-右旋糖酐)的某些组合。类似地,在低pH下酸水解的潜力可能使海藻糖成为蔗糖的替代品。易于从多家供应商那里采购蔗糖,与海藻糖相比,成本较低,这可能会使蔗糖成为首选的赋形剂。出于生产考虑,必须将这些考虑因素与适当的稳定性数据一起用于赋形剂的选择。
研究者还将膨胀剂添加到冻干产品中,以防止低浓度产品(≤1%固体)的产品“井喷”,提高产品崩溃温度和提高产品的美观度。赋形剂可用作无定形填充剂(例如蔗糖,海藻糖,乳糖,棉子糖,葡聚糖,羟乙基淀粉(HES))或结晶填充剂(例如甘氨酸,甘露糖醇)。非晶态赋形剂(例如HES)或高共晶温度(Teu)的玻璃化转变温度(Tg')高的赋形剂)用于结晶赋形剂(例如甘氨酸和甘露醇),可以使初级干燥更快。然而,水合形式的甘露醇的存在以及制造过程中玻璃破裂的可能性(由于高填充量,不正确的冷冻方案或高浓度)可能会限制在辅料筛选过程中对甘露醇的选择。
疫苗制剂中的佐剂
疫苗制剂通常包含称为佐剂的其他用于免疫增强的成分。佐剂更常用于亚基,蛋白质和肽抗原,并有助于增强抗原的固有免疫原性。铝基佐剂,例如氢氧化铝(Alhydrogel)和磷酸铝(AdjuPhos),由于其历史悠久的安全性和功效特征,是人类最常用的佐剂。从历史上看,抗原与铝基佐剂的结合被认为是重要的,尽管最近的一些研究表明,抗原-佐剂的结合不一定总是必要的。在最终确定要使用的佐剂类型和数量之前,重要的是要了解抗原-佐剂的相互作用及其对稳定性和免疫原性的影响。铝佐剂的加入可以保证稳定抗原-佐剂复合物并防止佐剂表面上抗原的物理和化学降解的赋形剂。
结论
赋形剂的选择应基于对多种事件(包括原料药加工,冻融,溶解时间,过滤,混合,材料相容性,配制/填充过程,冻干过程,长期稳定性,光敏性,冷藏超时(TOR),使用中的稳定性(重构后的稳定性)和运输。赋形剂必须适合预期的市场,并且在可能的情况下必须使用药典(USP / NF,EP,JP)级。生物制剂和疫苗大多为肠胃外给药而配制,需要不含内毒素的赋形剂。
参考文献:
5、Banks DD, et al. The Effect ofSucrose Hydrolysis on the Stability of Protein Therapeutics During AcceleratedFormulation Studies. Pharm. Sci. 98(12), 4501–4510 (2009)
本文来源于生物制品圈
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多