治疗性抗体的抗药抗体(ADA)“面面观”
治疗性抗体已成为现代肿瘤学的主要治疗武器之一,主要作为靶向治疗和免疫检查点抑制剂。然而,给药后产生的抗药物抗体(ADA)可改变其药代动力学、药效学、疗效和安全性,导致输液相关副反应。一些因素与ADA的发生有关,特别是宿主遗传和免疫状态、抗体的分子结构、剂量和给药途径等。ADA通常不会在日常临床实践中进行测试,它们的分析通常放在药物开发的早期阶段。酶联免疫吸附试验是最常见的检测方法。ADA的检测对癌症患者的治疗策略、指导治疗调整具有重要意义。这里将简单介绍下肿瘤方向治疗性抗体的ADA有关方面。
ADA产生最初与第一批上市抗体含有大量的小鼠序列有关。它们被人体免疫系统识别为异物是免疫原性出现的关键步骤(图1)。为了解决该问题,生物工程的进步产生了嵌合(鼠-人)抗体、人源化抗体和全人源抗体。然而,尽管免疫原性降低了,但并没有完全消除,而且ADA可以在所有类型的治疗性抗体出现,无论它们的分子结构如何。ADA的产生涉及不同途径对免疫系统的刺激,不能归因于单一因素。适应性免疫反应和非适应性免疫反应均可参与。
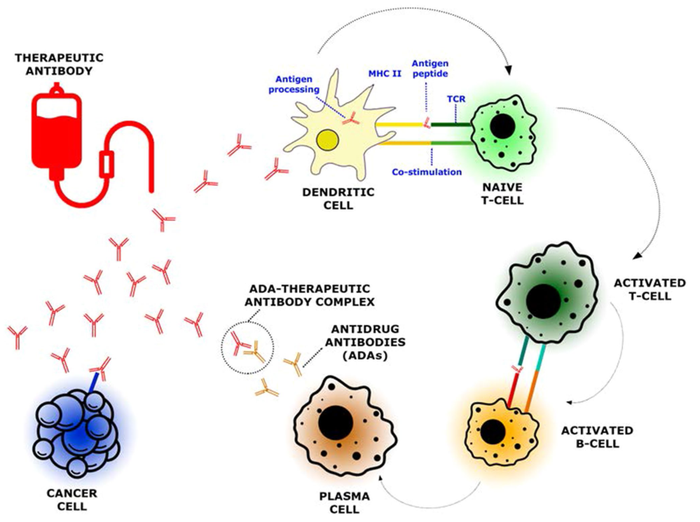
ADA的产生依赖于患者和药物的相互作用。宿主的免疫环境非常重要,主要是人类白细胞抗原等位基因。ADA可以通过T淋巴细胞依赖或T淋巴细胞非依赖途径产生。T依赖途径涉及将治疗性抗体作为抗原,通过抗原提呈细胞内化,然后通过MHC II类分子和T细胞受体之间的相互作用被加工并呈递给T细胞。辅助性T细胞随后将与B细胞接触,诱导其增殖和分化为浆细胞,浆细胞将合成和分泌针对抗体的特定ADA。反应的调节将取决于主要的T淋巴细胞类型:T辅助淋巴细胞或T调节性淋巴细胞。相反,T非依赖性途径涉及表达多个表位的抗体,这些表位本身可以与B细胞受体相互作用,刺激浆细胞合成ADA。抗体中的杂质可以增加表位的数量和这种类型的反应。
ADA的发生通常是一个早期事件,通常发生在第一次药物注射期间。最常见的时间线是最初的低亲和力和非中和的IgM反应,然后是较高的亲和力和中和的IgG1和IgG4反应。与ADA的形成有关的一些因素包括患者的遗传基础,免疫状态,癌症分期,以及伴随的抗癌治疗和其他药物治疗方式。另一方面,与抗体本身相关的因素有:抗体的剂量、给药方式、治疗时间、生物学结构、储存和杂质等。然而,在临床特征相似且接受相同药物治疗的患者中,ADA的产生是不同的,并且仍然不可预测。
在抗体的开发过程中,必须测试其潜在的免疫原性。通常对ADA检测的研究是基于酶联免疫吸附试验(ELISA)技术。通常通过连接不同标记的抗体分子来检测ADA。但该方法可能有许多干扰因素影响结果,因此在评估时必须谨慎。此外,这些研究缺乏标准化来比较不同实验室和医院之间以及不同抗体之间的ADA水平。
在临床前阶段,由于药物与动物免疫系统的相互作用不表现出与人体相同的特征和复杂性,ADA的早期开发不能完全评估人的情况。在这种情况下,许多接近真实ADA产生的实验工具已经开发出来,并提供了临床前有用的信息。这些方法包括人类白细胞抗原结合试验、T细胞刺激试验、外周血单核细胞刺激试验和各种动物模型。此外,蛋白质组学的最新进展推动了MHC-II多肽表位文库的构建,使免疫原性预测算法成为可能。
在临床一期试验中,当抗体首次在人类身上使用时,可以仔细和认真地分析ADA的合成及其与药代动力学、药效学和疗效曲线的可能关系。在这种情况下,ADA分析的一个重要因素是中和ADA和非中和ADA之间的区别。中和ADA通过直接与位于抗体活性部位内的表位结合或通过与可能位于活性部位附近的表位结合来阻断治疗分子的生物活性。相反,非中和的ADA与抗体的非活性表位结合,并不一定会导致治疗活性的降低。这种区别需要深入的实验室研究。通常,最初使用免疫分析方法对样品进行分析,以确定ADA的存在。在免疫分析中产生阳性结果的样本随后使用基于细胞的体外分析或非基于细胞的竞争配体结合分析来测试中和活性。
ADA的出现是使得药物从动物模型转化为临床试验和临床过程中终止的最常见原因之一,例如,降脂药物bococizumab,它在很大比例的患者中引发ADA,显著减弱其降低胆固醇的水平,因此FDA和EMA发布了评估抗体免疫原性的指南。然而,随着现代抗体设计的进步,抗体免疫原性已经大大降低。随着免疫治疗药物的使用,抗体的免疫原性进一步减少。
ADA与临床相关性在于它们与抗体相互作用的能力,可以影响其药代动力学和药效学特性,因此能够降低其疗效。一方面,如果ADA被导向抗原结合部位(中和ADA),则复合抗体-ADA将不具有生物活性,从而导致抗体的药效学性质改变。另一方面,抗体和ADA之间形成的免疫复合体的大小和组成可能不同,这可以加速它们被肝脏和脾捕获,并触发免疫系统的激活,扰乱循环水平,致使药物被快速清除。这些使得药物的最大浓度和暴露量降低,进而对治疗效果产生不良后果。
由于这些原因,ADA可导致药物的原发或继发耐药,因此有必要进行常规的ADA水平测试和常规的抗肿瘤药物水平测试。然而,ADA在肿瘤学中的相关性才刚刚开始被认知,而且它们在日常临床辅助中的研究并不标准化,它们的方法通常被归类到药物开发的早期阶段。早期的这些测试在后期的治疗策略中可能具有很大的指导意义,如延长或减少给药间隔,增加或减少药物剂量,或是否停止药物治疗。
风湿学和血液学领域的一些研究已经奠定了ADA行为的基础,将其与抗体的血液水平、毒性和疗效进行匹配。抗体注射后最明显的不良反应之一与促红细胞生成素前体药物有关。在1998至2003年间,全世界检测到191例红细胞再生障碍性贫血,与药物本身和内源性促红细胞生成素的ADA产生有关。这种严重的不良反应在医学界引起了极大的警觉,导致了药物开发中ADA检测的标准化。
西班牙的一项研究跟踪了85名接受英夫利昔抗体治疗的类风湿关节炎患者。32%患者的有ADA产生,它们与药物疗效较低有关,而且在大多数无应答患者中都能检测到。此外,它们还与总体存活率的较差结果有关。
在用英夫利昔抗体治疗108名类风湿性关节炎和脊柱炎患者的研究中也得到了类似的结果。19%的患者检测到ADA,ADA滴度与英夫利昔抗体血药浓度呈负相关。此外,在产生ADA的患者中,英夫利昔抗体较早停用。这项研究最重要的观察之一是,与未接受甲氨蝶呤治疗的患者相比,同时接受甲氨蝶呤治疗的脊柱炎患者患ADA的风险较低(0%对32.5%)。这些研究为同时使用免疫抑制剂治疗可能的益处提供了理论基础。
另一项研究分析了272名服用阿达木抗体治疗的类风湿关节炎患者。术后3年随访,28%的患者出现ADA。ADA阴性患者的阿达木抗体浓度高于ADA阳性患者。此外,ADA阳性患者因治疗无效而较早停止治疗。
在肿瘤学方面,最近进行了一些关于抗体治疗后ADA产生的研究。一项研究分析了32名接受利妥昔抗体治疗的不同类型淋巴瘤和白血病患者、43名接受曲妥珠抗体治疗乳腺癌患者的外周血液样本。12.5%的利妥昔抗体患者和16.3%的曲妥珠抗体患者发现ADA的产生。另一项研究分析了31例晚期黑色素瘤患者的ADA水平及其与血清ipilimumab浓度和疗效的关系。26%的患者在随访期间发生了ADA,并且ADA的产生与较短的总生存期显著相关。
需要指出是新的抗体形式,如双特异性,可能会增加免疫原性的风险。Hellmann等报告了在剂量递增阶段I期试验中,12名患者都出现了针对TIM3-PDL1双特异性抗体的ADA产生,而且ADA的产生与剂量无关,并在治疗的早期阶段就可观察到。更重要的是,两名患者出现了与输液相关的反应。
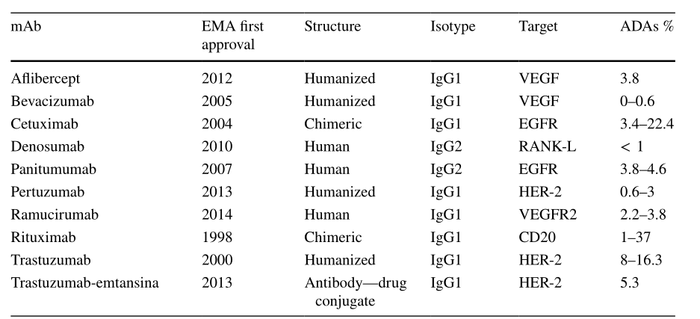
最近发表的一些研究分析和总结了肿瘤学中最常见的免疫治疗和靶向治疗抗体产生的ADA的百分比(表1和表2 )。研究发现,具有相似作用机制的药物,ADA的发生率范围很广,即使针对同靶点的抗体ADA发生率也不近相同,而且人源化抗体和全人源抗体在ADA产生方面并无显著差异。
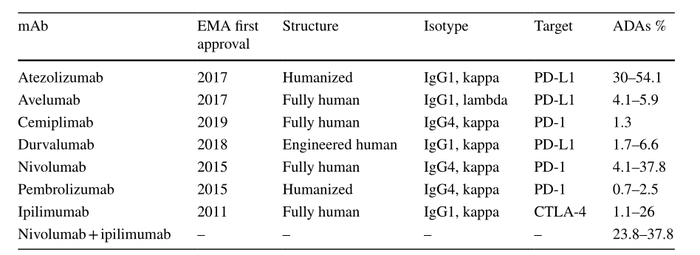
表1. ADA在肿瘤检查点抑制剂中的应用
已经提出了几种策略来降低治疗性抗体的免疫原性。最重要的进展是,与鼠或人嵌合抗体相比,研制出的完全人源化或人源化的抗体降低了诱发ADA的风险。基于纳米抗体的生物制剂代表了另一种方法,它们只包含重链的可变区,比传统的抗体小得多,免疫原性也可能较低。利用蛋白质工程技术去除治疗性抗体中的T细胞和B细胞表位也可能有助于通过限制B细胞的激活来降低其免疫原性。最终产品的翻译后修饰和配方中辅料选择也有可能改善治疗性抗体的免疫原性。一些数据表明,化疗和免疫治疗的组合可能会减少ADA的产生,这源于化疗的免疫抑制效应。在临床试验中正在测试皮质类固醇和免疫疗法的组合。这种疗法在具有自身免疫的疾病,如克罗恩病,被证明是有益的。另外,基于一些风湿病研究中甲氨蝶呤等药物对ADA产生抑制的相同的免疫抑制原理,一些早期肿瘤临床试验正在使用抗CD20 obinutuzumab和抗IL-6 tocilizumab作为正式治疗前预处理。
治疗性抗体是过去几十年中在癌症治疗的取得重大进展。然而,在早期临床开发中,ADA的产生阻碍了一些药物的进展。ADA可改变抗体的药代动力学、药效学和疗效,导致临床效果不佳。最近有关接受靶向治疗和免疫检查点抑制剂治疗的患者发生ADA数据表明,ADA影响许多治疗性抗体的有效性和安全性,临床医生和医药公司目前也在越来越重视这方面的研究。因此药物开发过程中对药物ADA影响的解读将成为药物开发成功与否的关键因素之一。
1.Anti‑drug antibodies in the current management of cancer.
2.Antidrug antibodies and drug development: challenges in the immunotherapy era.
3.Development of anti-drug antibodies is associated with shortened survival in patients with metastatic melanoma treated with ipilimumab.
4.Safety and immunogenicity of LY3415244, a bispecific antibody against TIM-3 and PD-L1, in patients with advanced solid tumors.
5.Review on modeling anti-antibody responses to monoclonal antibodies.
本文来源于生物制药小编
















评论
加载更多