新冠病毒是单股正链RNA病毒,其刺突(S)蛋白与人体细胞膜上受体ACE2结合后进入细胞并释放出病毒RNA,病毒RNA在宿主细胞中翻译成两条多聚蛋白pp1a和pp1ab,这两种多聚蛋白被3CLpro和PLpro切割,裂解为多种新冠病毒所需的非结构蛋白(NSP),随后在RNA聚合酶(RdRp)等多种非结构蛋白的共同作用下复制-转录,翻译出子代结构蛋白,再与子代正链RNA相结合,通过高尔基体和ERGIC管腔组装成为新的病毒粒子释放。
目前新冠药物主要围绕病毒侵入人体增殖过程中不可或缺的
刺突(S)蛋白
、
3
CL蛋白酶
、
RNA聚合酶
三个靶点开展研究。
中和抗体通过与新冠病毒表面刺突(S)蛋白的受体结合域结合,从而阻断病毒与ACE2结合令病毒无法进入细胞,起到治疗效果。中和抗体研发速度快,可抢先获批上市,但易因新冠病毒表面S蛋白突变造成免疫逃逸而减弱或失去疗效。
以3CL蛋白酶抑制剂和RNA聚合酶抑制剂为代表的小分子
药靶点保守
,不易受病毒变异影响,且部分产品口服便利、可常温存储运输、成本低于中和抗体,成为医药企业主要研发方向,占据当前市场主流地位。
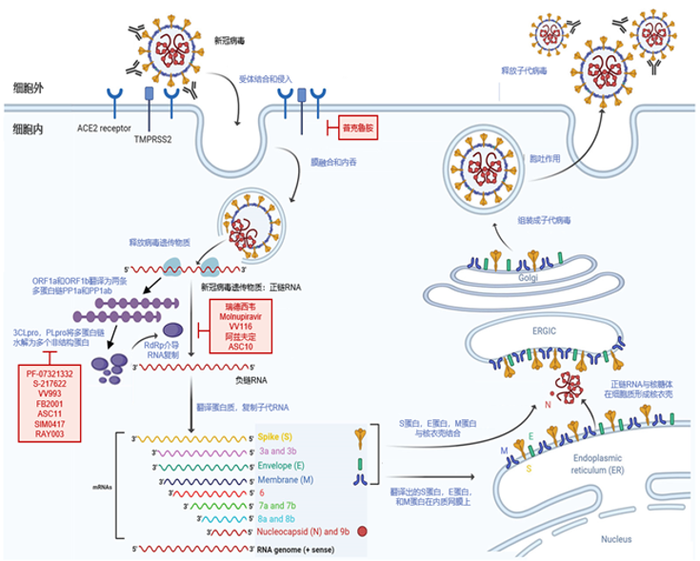
图1. 新冠病毒生命周期及小分子药物作用机理,来源:国金证券
据不完全统计,共计10款新冠药物已获美国FDA批准或紧急授权,其中小分子药4款,包括1个3CL蛋白酶抑制剂,2个RNA聚合酶抑制剂,5个中和抗体;抗体药物6款,包括5个中和抗体和1个IL-6受体抑制剂。
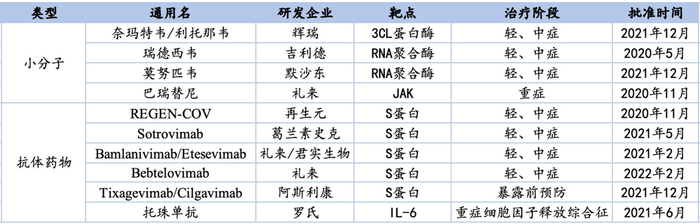
在炙手可热的新冠口服药赛道中,辉瑞的Paxlovid最为瞩目。Paxlovid由3CL蛋白酶抑制剂奈玛特韦(PF-07321332)和利托那韦组成,
奈玛特韦
抑制新冠病毒复制,
利托那韦
通过抑制奈玛特韦的体内代谢,延长其体内有效血药浓度。
4月14日,Paxlovid的II/III期临床数据在新英格兰医学期刊上发表,该研究共有2102例患者参与,按1:1随机分组接受Paxlovid或安慰剂治疗,每12小时给药一次,持续5天治疗。治疗开始后第28天安慰剂组住院66例,其中12例死亡;治疗组住院8例,无死亡事件,住院或死亡风险显著降低。
4月21日,WHO发布针对新冠肺炎新的治疗推荐,强烈推荐Paxlovid用于治疗有高度住院风险的新冠肺炎轻度或中度患者。
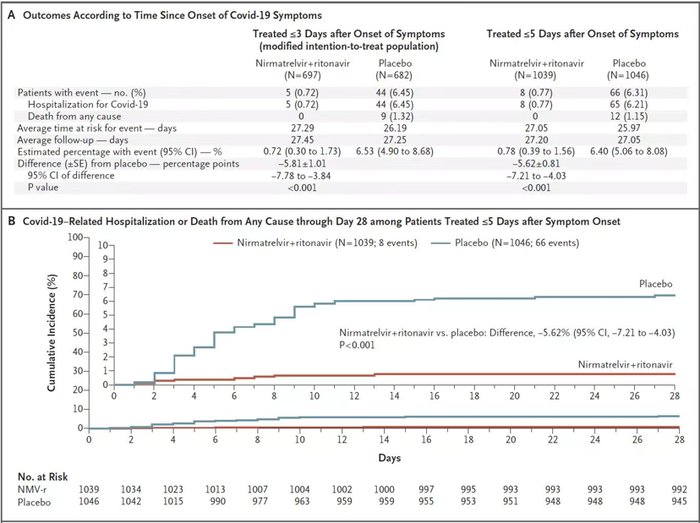
图3. Paxlovid II/III期临床试验结果
在2021年12月22日获得FDA的EUA批准后,辉瑞立即拿下美国政府2000万疗程订单。根据辉瑞年报,Paxlovid 2021年的收入为7600万美元。
5月3日,辉瑞公布一季度业绩报告,Paxlovid一季度销售额为14.7亿美元,远低于预期。或受限于产能,辉瑞到3月底仅交付600万疗程,目前订单满产,预计今年上半年交付3000万疗程,下半年9000万疗程,维持全年1.2亿疗程产能、220亿美元销售预期不变。近期,美国政府宣布将扩大Paxlovid口服药的获取渠道,并鼓励更广泛使用,预计全美直接配送点将从2万增加到4万。
由默沙东与Ridgeback Biotherapeutics公司合作开发的莫努匹韦Molnupiravir是RNA聚合酶抑制剂,可与新冠病毒的RNA聚合酶结合,在新合成的RNA分子中引入错误的核苷酸,从而起到抑制或清除病毒的作用。该药是全球首款获批用于治疗轻至中度成人患者的新冠口服药,最早于2021年11月4日在英国获批上市,12月23日获美国紧急授权。
2021年11月26日,默沙东公布的莫努匹韦III期临床数据显示可降低30%的住院/死亡风险(6.8% vs 9.7%)。默沙东曾在2021年财报中披露,莫努匹韦2022年预计销售收入为50-60亿美元。在最新公布的一季度财报中,莫努匹韦销售额达到32亿美元,远超预期。
瑞德西韦是FDA唯一正式获批用于新冠住院患者的药物
,尽管其疗效存在一定争议,2021年瑞德西韦全球销售达到55.6亿美元,同比增长98%。2022年一季度,瑞德西韦销售同比增长15%至15亿美元。今年4月25日,FDA批准瑞德西韦作为首个用于婴幼儿的新冠疗法,可用于28天及以上、体重至少3公斤且新冠病毒阳性结果的儿童患者。
礼来公司的自身免疫疾病用药巴瑞替尼是唯一获批治疗新冠重症的药物,可降低38.2%死亡风险。该药2021全年销售达11.15亿美元,同比增长74%,目前正在开展用于治疗斑秃的III期临床研究,有望成为FDA批准的首款治疗斑秃药物。
我国目前有3款新冠药物获得药监局批准,分别为以岭药业的连花清瘟胶囊/颗粒、腾盛博药的中和抗体安巴韦单抗/罗米司韦单抗、辉瑞的小分子口服药Paxlovid。鉴于中和抗体面对变异株疗效减弱,2300元一盒的Paxlovid价格高昂,面对严峻的疫情形势,我们亟需拥有安全高效、经济实惠的新冠口服药。
据不完全统计,国内新冠口服药在研产品共计14款,其中3CL蛋白酶抑制剂8个,RNA聚合酶抑制剂4个。
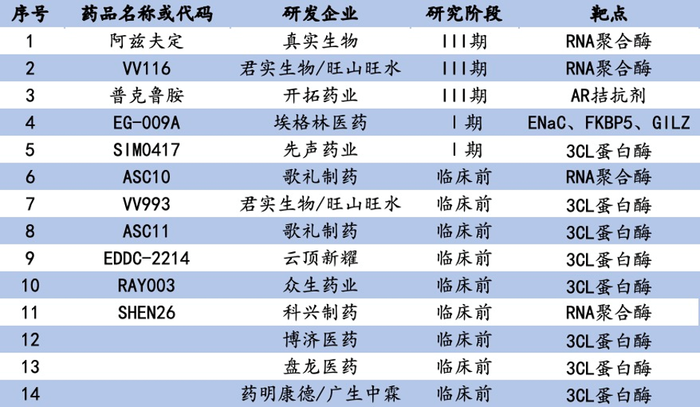
真实生物的阿兹夫定普遍认为有望成为国产首款新冠口服药。4月2日,药审中心网站上真实生物III类沟通交流会申请的当前状态从“处理中”变更为“已反馈”,市场解读为阿兹夫定三期临床揭盲、申报上市在即。
阿兹夫定是2021年7月获批上市的全球首个抗HIV创新药,因抑制新冠病毒RNA聚合酶发挥抗病毒作用。4月16日,蒋建东院士在中国医学发展大会上介绍了阿兹夫定在治疗新冠适应症上的研发进展。从II期到III期临床结果来看,患者口服阿兹夫定3-4天核酸转阴,平均用药时间6-7天,平均9天出院,重症与轻症治疗效果相似。
与瑞德西韦对比,阿兹夫定每日口服5mg,相比瑞德西韦每日注射100mg,临床效果显著优于瑞德西韦。目前阿兹夫定在中国、巴西、俄罗斯的III期临床已经结束,正处于申报上市阶段。引人注意的是,阿兹夫定已经特批给各使馆、北京冬奥会志愿者、驻港部队等,为预防用药提供更多遐想空间。
5月8日晚间,“犹抱琵琶半遮面”的华润双鹤发布公告称,公司与真实生物签署《战略合作协议》及《阿兹夫定片委托加工生产框架协议》,随即华润双鹤5月9日、10日迎来连续两日强势涨停,而此前公布与真实生物战略合作关系的新华制药连续九日一字涨停,足见资本市场对“新冠口服药”的狂热。
4月19日,中国临床试验注册中心网站公示了君实生物/旺山旺水VV116与辉瑞Paxlovid早期治疗轻-中度新冠肺炎的头对头、多中心、单盲、随机、对照III期临床研究。一石激起千层浪,VV116选择与全球疗效最显著的新冠口服药直接进行比较,一旦结果为非劣效,都将给VV116的审批与市场前景带来极大助力。
VV116由中国科学院上海药物研究所、中国科学院武汉病毒研究所、旺山旺水生物医药有限公司等多家机构联合开发,2021年9月君实生物与旺山旺水开启合作,共同承担VV116在全球范围内的临床开发和产业化。2021年12月30日,VV116在乌兹别克斯坦获得紧急使用授权,该授权基于VV116在乌兹别克斯坦完成的一项中、重症新冠肺炎临床试验,研究表明VV116可以改善患者临床症状,缩短核酸转阴时间,并显著降低危重症及死亡风险。目前,VV116多项针对轻中度和中重度新冠患者的国际多中心III期临床研究正在进行中。
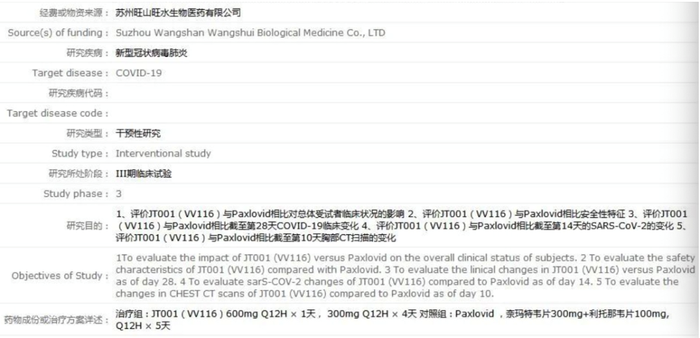
图6. 君实生物/旺山旺水VV116与辉瑞PaxlovidIII期临床研究
普克鲁胺是雄激素受体(AR)拮抗剂,可能通过抑制ACE2和TMPRSS2表达而阻碍病毒进入宿主细胞、激活Nrf2通路抑制炎症因子,产生这双重作用起到治疗效果。2021年3月,开拓药业宣布在巴西进行的重症新冠患者临床试验显示,普克鲁胺可将重症新冠患者的死亡风险降低92%,缩短平均住院时间9天,数据亮眼。然而2021年12月27日,开拓药业公布III期临床中期试验未达到统计学显著性,令其股价一度超跌80%。
今年4月6日,开拓药业公布了普克鲁胺治疗轻中症新冠患者的全球多中心III期临床试验的关键数据。结果显示,普克鲁胺可有效降低新冠患者的住院/死亡率,对于完成服药超过7天的患者人群,相应保护率达100%。同时,普克鲁胺可显著持续降低新冠病毒载量,并改善新冠相关症状。
步入新冠疫情后半程,真实生物的阿兹夫定、君实生物/旺山旺水的VV116、开拓药业的普克鲁胺——是跑在最前端的三驾马车,谁将最终脱颖而出,让我们拭目以待!
截至目前,上海市累计感染人数已逾60万人,相当于上海常住人口每50人中就有1.3人感染,虽然我们看到好转的希望,但也付出了惨重的代价。我们不得不承认,历经三年与新冠病毒的拉锯战,迄今依然没有找到遏制疫情扩散蔓延的有效手段,依然有诸多未解之谜等待科研人员去挖掘。
“动态清零”是目前我国新冠肺炎疫情防控的总方针,其精髓在快速与精准,“动态”指不追求绝对零感染,“清零”意味着发现一起、扑灭一起,守住不出现疫情规模性反弹的底线。如何在防控疫情同时切实保障人民基本生活需求、最大程度避免“次生灾害”的发生与对经济的负面影响,需要协调各部门紧密配合、迅速高效调动一切可利用资源,需要追踪新冠病毒的变异特点,做到“动态”调整优化防疫策略。
本文来源于药渡



















评论
加载更多