如何做好一份工艺变更?
根据工艺、设备变更管理程序执行改进建议;按照“谁主管、谁负责”的原则执行规定,并提供培训、监督与考核。按改变的大小,可以分为:
工艺设备变更:涉及工艺技术、设备设施、工艺参数等超出现有设计范围的改变(如压力等级改变、压力报警值改变等)。
微小变更:影响较小,不造成任何工艺、设计参数等的改变,但又不是同类替换的变更,即“在现有设计范围内的改变”。
同类替换:符合原设计规格的更换。

适用于公司及各承包商以下变更管理:
-
生产能力的改变。 -
物料的改变(包括成分比例的变化)。 -
化学药剂和催化剂的改变。 -
设备、设施负荷的改变。 -
工艺设备设计依据的改变。 -
设备和工具的改变或改进。 -
工艺参数的改变(如温度、流量、压力等)。 -
安全报警设定值的改变。 -
仪表控制系统及逻辑的改变。 -
软件系统的改变。 -
安全装置及安全联锁的改变。 -
非标准的(或临时性的)维修。 -
操作规程的改变。 -
试验及测试操作。 -
设备、原材料供货商的改变。 -
运输路线的改变。 -
装置布局的改变。 -
产品质量的改变。 -
设计和安装过程的改变。 -
其他。
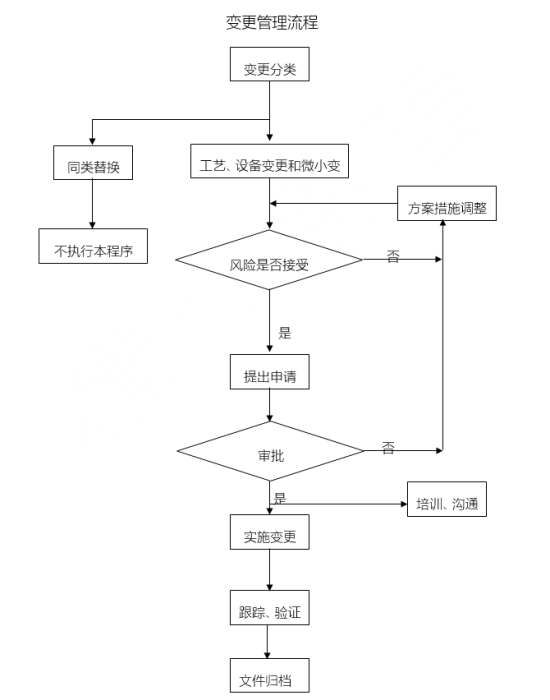
工艺设备变更的基本类型包括工艺设备变更、微小变更和同类替换,所有的工艺设备变更应按其内容和影响范围正确分类。工艺设备变更和微小变更管理执行变更管理流程。同类替换不执行变更管理流程。
工艺设备变更应实施两级管理,根据变更影响范围的大小和所需调配资源的多少,确定变更级别。
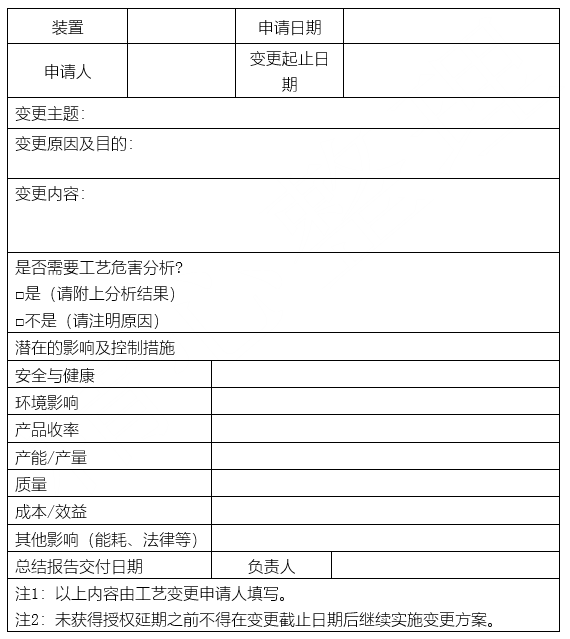
变更申请人应初步判断变更类型、级别,做好实施前的各项准备工作,提出变更申请。
变更应充分考虑健康安全环境影响,并确认是否需要危害分析。对需要做危害分析的,分析结果及采取的风险控制措施应作为变更申请的主要内容。
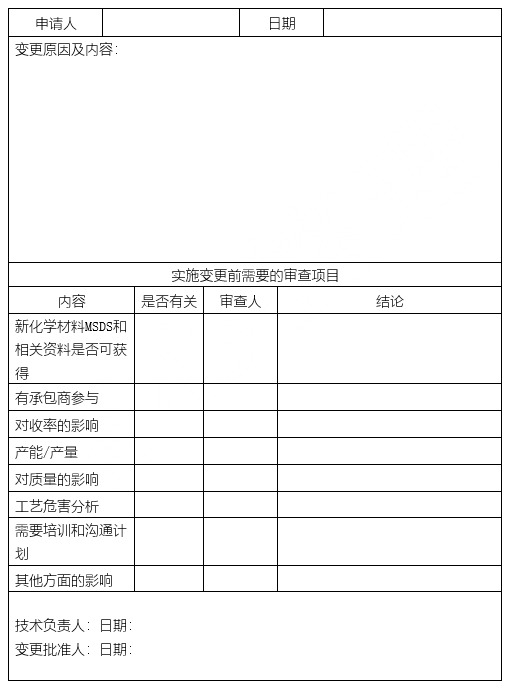
各单位按照变更的类型、公司级或生产部级审批权限。在满足所有相关工艺、设备、健康、安全、环境的条件下,经专业部门或专业人员审核,由公司主管领导批准或生产部经理批准。
变更审批内容:
l 变更目的。
l 变更涉及的相关技术资料。
l 变更内容。
l 变更带来的健康安全环境影响(危害分析及风险削减措施)。
l 涉及操作规程修改的,审批应提交修改后的操作规程。
l 对人员培训和沟通的要求。
l 变更的限制条件(如时间期限、物料数量等)。
l 强制性批准和授权的要求。
变更实施涉及启动前安全检查,执行《启动前安全检查管理规定》;涉及作业许可,执行《作业许可管理规定》。
变更涉及的所有资料以及操作规程都应确保得到适当的审查、修改或更新。
变更应严格按照变更审批确定的内容和范围实施,并对变更过程实施跟踪。
完成变更的工艺、设备在投用前,应对变更影响或涉及的人员进行培训或沟通,培训内容包括变更的目的、作用、程序、变更内容、变更中可能的风险和影响以及同类事故案例。
变更影响或涉及的人员包括:
-
变更所在区域的人员,如维修人员、操作人员等。 -
变更管理涉及的人员,如工艺管理人员、培训人员等。 -
其他相关人员,如承包商、外来人员、供应商等。

变更所在区域或单位应建立变更工作文件、记录,以便做好变更过程的信息沟通。工作文件、记录包括变更管理程序、变更申请审批表、风险评估记录、变更登记表以及变更结项报告等。
变更实施完成后,应对变更是否符合规定内容,达到预期目的进行验证,提交变更结项报告,并完成以下工作:
-
所有与变更相关的工艺技术信息都已更新。变更可能引起其它连带的变更,如工艺安全信息、管理程序、培训要求等发生变化,各单位必须对此逐项确认,落实连带变更项的负责人和完成日期。 -
规定了期限的变更,期满后应恢复变更前的状况。 -
试验结果记录在案。 -
确认变更结果。 -
变更实施过程的相关文件归档。
在变更结束后,各单位技术管理责任人负责将变更的相关资料存档,包括变更审批表、工艺安全分析报告以及建议的解决方案等。
变更更新的工艺流程图,管线与仪表图,设备数据表,联锁报警值,操作与维修程序,操作与维修保养记录表,新增加的材料安全技术说明书(MSDS)等,必须在生产现场和生产单位技术资料室各存档一份,同时销毁废止文件。
本文来源于制药人职场加油站
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多