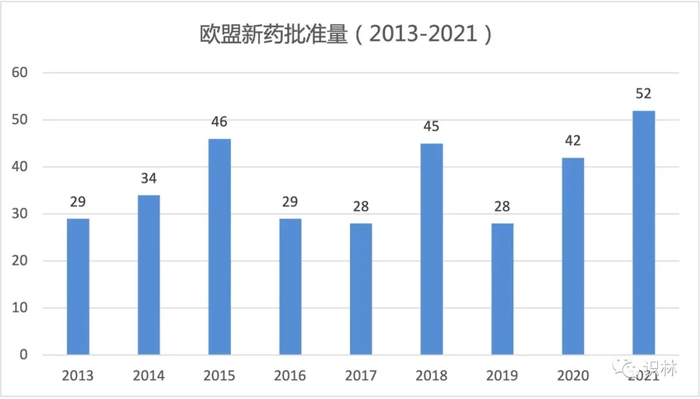
2021 年欧盟新药批准创历史新高,52 个含新活性成分的药物
2021 年欧盟批准了创纪录的 52 个含有新活性成分(NAS)的药物,其中包括批准了用于新冠疾病的 4 个新疫苗和 3 个新药。
与 2020 年(42 个含 NAS 的产品)相比,该数字增加了近四分之一,比 2019 年(28 个)增加了近一半。过去十年中,创下批准最多记录的一年是 2015 年,有 46 个含 NAS 新药获得上市许可(MA)。
孤儿药与&肿瘤药
与 2020 年一样,2021 年批准了 17 个罕见病药物。其中包括 Deciphera Pharmaceuticals 公司用于治疗晚期胃肠道间质瘤的 Qinlock (ripretinib),Incyte Corporation/MorphoSys AG 公司用于治疗弥漫性大 B 细胞淋巴瘤的 Minjuvi (tafasitamab),以及罗氏用于 5q 脊髓性肌萎缩症儿科患者的 Evrysdi (risdiplam)。
另外批准了 17 个用于肿瘤适应症的新药,其中一个是新基/百时美施贵宝公司用于成人复发和难治性多发性骨髓瘤患者的基因疗法 Abecma (idecabtagene vicleucel)。
另一获批上市的基因疗法是 bluebird bio 公司用于早期脑型 X 连锁肾上腺脑白质营养不良症的 Skysona (elivaldogene autotemcel)。
值得注意的是,去年批准的产品之一包含两种新活性成分:罗氏/再生元的新冠治疗药 Ronapreve (casirivimab + imdevimab) 。而另外两个新药,口服避孕药 Gedeon Richter 公司的 Drovelis 和 Estetra 公司的 Lydisilka 含有相同的 NAS — 雌四醇(与屈螺酮组合)。
阿斯利康的 Lumoxiti 批准被撤回
17 个肿瘤药批准之一是阿斯利康公司用于成人复发或难治性毛细胞白血病患者的 Lumoxiti (moxetumomab pasudotox),该产品是在特殊条件下获得批准的孤儿药。上市许可在获批 5 个月后因商业原因应申报人要求撤回。
有条件上市许可
2021 年,14 个新产品在欧盟获得有条件上市许可(CMA)。在 CMA 下获得许可的申办人同意提供更多产品数据,以期最终转为完整的上市许可。
新冠产品
去年的 CMA 包括四个新冠疫苗:Moderna 公司的 Spikevax,AstraZeneca/牛津大学的 Vaxzevria,强生新冠疫苗,以及 Novavax 的 Nuvaxovid。欧盟首个新冠疫苗辉瑞/BioNTech 的 Comirnaty 已于 2020 年 12 月获得批准。
2021 年,欧盟还根据标准上市许可程序批准了 3 个含有 NAS 的新冠治疗药:罗氏/再生元的 Ronapreve,Celltrion 的 Regkirona (regdanvimab)以及葛兰素史克/Vir 公司的 Xevudy (sotrovimab)。
另外,还有两个现有用于炎症性疾病的药物 — 瑞典 Orphan Biovitrum AB 公司的 Kineret (anakinra)和罗氏/Chugai 公司的 Actemra/RoActemra (tociluzumab),将欧盟适应症扩展到包括治疗严重新冠疾病患者。
特例批准
4 个新药受益于另一欧盟监管机制:特例批准 , 这 4 个药分别是:Stemline Therapeutics 公司用于母细胞性浆细胞样树突状细胞肿瘤的 Elzonris (tagraxofusp),再生元用于纯合子家族性高胆固醇血症的 Evkeeza (evinacumab),Albireo Pharma 公司用于治疗进行性家族性肝内胆汁淤积症的 Bylvay (odevixibat) , 以及批准后撤回的 Lumoxiti。
特例批准用于因为所讨论的疾病很少遇到或者收集信息是不道德的,从而在正常使用条件下不能期望申办人提供关于其产品的全面安全性和有效性数据的情况。
加速审批
两个孤儿药 Bylvay 和 Evrysdi 于 2021 年在加速程序下获得批准。欧盟加速审批用于对公共卫生具有重大意义的药物 , 审评时间为 150 天,而不是标准的 210 天。
来源:识林
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略














评论
加载更多