一种新蛋白质的结构将帮助科学家设计更好的药物
在消化过程中,我们吃的蛋白质被分解成更小的碎片,称为肽,它由氨基酸组成,我们的身体后来用来构建自己的蛋白质。在这之前,肽必须首先从肠道运输到血液中。这项任务由一种叫做肽转运体1(PepT1)的分子完成,它位于肠壁的细胞膜上,将小肽穿过细胞膜。
在人体中,大约有800个运输系统专门用于不同种类的营养物质。它们中的大多数是非常专业的。例如,某些糖类运输工具只能吸收一种类型的糖。然而,PepT1是不同的,它可以运输几乎任何类型的短肽。在科学术语中,这种能力被称为 "杂交"。
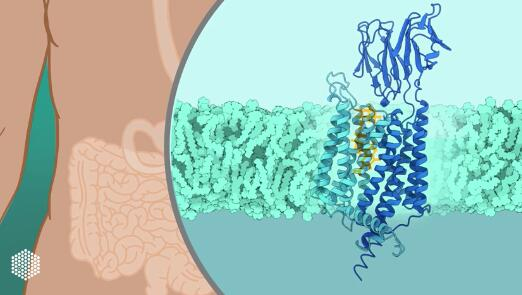
组长Christian Löw是汉堡EMBL的膜蛋白专家。他的小组与来自结构系统生物学中心(CSSB)和汉堡-埃彭多夫大学(UKE)的同事一起,确定了人类PepT1及其相对的PepT2的分子结构,后者主要存在于肾脏中用于营养吸收。科学家们使用了低温电子显微镜,这是一种使用电子而不是光对冷冻样本进行成像的技术。
改进药物设计的新可能性
PepT1的杂交性使其不仅能运输营养性肽,还能运输各种类型的药物,包括某些抗生素、抗病毒药物和治疗高血压的药物。然而,PepT1运输药物的效率低于它运输许多天然肽的效率。因此,我们摄入的药物中只有一小部分最终进入我们的血液。其余的留在肠道中,这可能导致各种副作用。增加药物的剂量以弥补低效的运输,对于抗生素来说特别危险,因为它可能导致产生抗生素的细菌。
Löw说:"现在我们知道了PepT1的结构是什么样的,将有可能设计出利用PepT1穿越肠道壁的新药物,比以前更有效。"人类PepT1的结构将使我们能够通过使吸收更有效率来改进药物设计。目前,几乎不可能预测候选药物是否能通过这一运输系统穿过肠壁。直到现在,获得这样的药物一直是非常具有挑战性的。许多潜在的有效候选药物在临床前研究中失败了,因为它们的吸收率很低。在PepT1结构信息的帮助下,其中一些失败的候选药物可以被重新设计,使它们能够被PepT1有效地运输。同样,许多现有的药物可以被修改以改善其吸收。
在静止状态下观察转运器
人类PepT1的分子结构是用低温电子显微镜确定的最小的结构之一。它类似于一个向肠道内部开放的钳子。当一个肽与PepT1结合时,该钳子会围绕它关闭,然后向膜的另一侧打开以释放它。科学家们不仅确定了该转运器的结构,甚至还捕捉到它在转运周期中的各种状态。
该研究的第一作者Maxime Killer说:"我们将整个运输过程的分子细节可视化,就像在电影中一样。膜蛋白是出了名的难以研究,但我们希望我们为研究PepT1而开发的技巧将帮助其他科学家在未来解决类似蛋白的结构。"
来源:医药大观园
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多