FDA近5年批准新药标准揭示哪些趋势?(附FDA2021年批准的6款重磅新药)
近年来受到国内追捧的FDA批准新药模式以及在FDA高标准要求下的新药审批趋势具体如下:
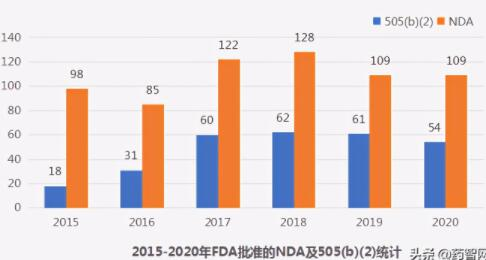
505(b)(2)
1984年,美国国会通过了《药品价格竞争和专利期修正案》(Hatch-Waxman Amendment),修订后的《联邦食品、药品和化妆品法案》505部分为新药申请提供了三种路径:505(b)(2)则为其中之一(以下只阐述505(b)(2)途径)。
505(b)(2)申请包含完整安全性和有效性研究报告,但至少有部分信息来源于非申请者开展或申请者无权引用的研究。通俗地说,505(b)(2)就是对已批准药物的改变,即改良型新药申请。近年来,FDA的505(b)(2)申报越来越受国内制药企业关注。
数据来源:药智数据;药智咨询整理
除2020年可能因COVID-19的影响而导致批准数目降低,近年来,505(b)(2)的申报数量逐年增多。值得注意的是:在2019年12月,由中国石药集团欧意药业有限公司自主研发的创新药马来酸左氨氯地平片(商品名:CONJUPRI)通过了FDA新药上市申请(505(b)(2))。
CONJUPRI是一种钙通道阻滞剂,用于治疗高血压。资料显示:CONJUPRI是首个获得FDA完全批准的中国本土创新药,也是我国第一个在美国上市的高血压新药。
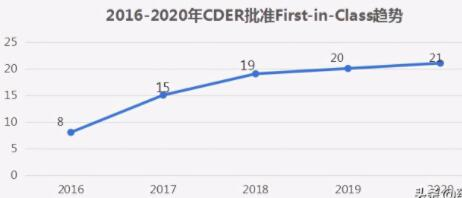
First in Class
First in Class即首创新药,可以间接的理解为505(b)(1),这些药物的作用机制通常与现有疗法不同。
行业人士曾指出:“First in Class本质就是走一条前人尚没有走过或走通的路。”CDER(FDA药品审评和研究中心)在2020年批准的53种新药中,有21种(占40%)被列为First-in-Class,这是该药物对美国人民的健康产生积极影响的潜力的一个指标。
数据来源:药智数据;药智咨询整理
在2020年,一些比较有代表性的首创药物如Rukobia(fostemsavir)片剂,一种新型的抗逆转录病毒药物,适用于患有HIV-1的成年人,在此之前曾尝试过多种HIV-1药物,但由于耐药性,不耐受性或安全性考虑而无法成功使用其他疗法治疗HIV-1感染。
Rukobia的批准标志着一类全新的抗逆转录病毒药物,可能有利于那些已经用尽了其他各种HIV-1治疗方案的患者。
1st U.S.
1st U.S.即Approval in the U.S. Before Other Countries,在药智企业版美国上市药品数据库中以“美国首批”标注,尽管FDA与其他国家或地区的药品监管机构在药品批准流程上很大的差异,但是每年仍有许多新药在其他国家批准之前获得了FDA的首次批准。
数据来源:药智数据;药智咨询整理
FDA基药
2020年8月6日,美国时任总统发布了一项”关于确保基本药物,医疗对策在美国生产”的行政命令,该行政命令指示FDA查明在任何时候都可提供的,足以满足患者需求的适当剂量和适当剂型的基本药物,医疗对策的清单。
FDA基药是美国急诊医疗机构中患者最需要的药物,专门用于严重伤害或疾病以及紧急医疗状况的短期治疗;也着重于包括医学上必需的药物,以便有足够的供应。通过检索药智美国上市药品数据库的“基药“筛选功能,便可获得更多相关信息。
2021上半年FDA批准近30款新药
据健康时报记者不完全统计,2021年上半年,美国食品药品监督管理局(FDA)批准了近30款新药上市,包括新实体药物、生物制品等,还批准了2款细胞疗法。
从疾病领域来看,2021年上半年FDA批准的新药仍以肿瘤药居多,其他包括神经精神、遗传性疾病、生殖泌尿系统疾病以及感染性疾病等领域也分别有新药获批。而在这些获批的药物中,有一些药物备受瞩目。
FDA2021年批准的6款重磅新药
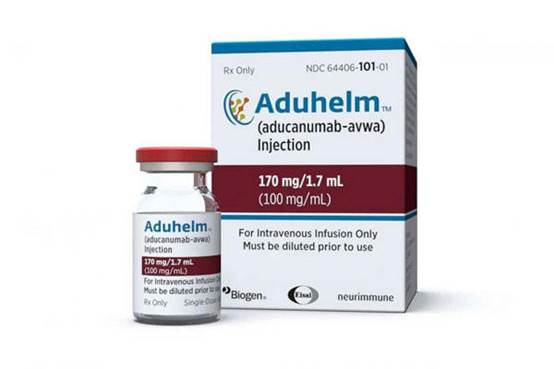
1、18年来首个治疗阿尔茨海默病新药:Aduhelm
2021年6月,FDA宣布加速批准渤健/卫材公司Aβ(β淀粉样蛋白)抗体Aduhelm用于治疗早期阿尔茨海默症(AD)患者的生物制品许可申请,这预示着该药物获批用于治疗早期阿尔茨海默病,而这也是时隔18年后,FDA再次批准的该治疗领域的新药。
该药的获批在某种程度上,对于患者而言是好消息,但是却在业内引起广泛讨论,甚至被业内人士称为是“一场灾难”,“可能是美国近期历史上最糟糕的药物批准决定”。
“我们最终决定使用加速批准途径,旨在为存在未满足需求的严重疾病患者提供潜在有价值的疗法,以及尽管在该获益方面存在一些残留不确定性,但预期临床仍获益的疗法。”FDA 认为,Aduhelm 对阿尔兹海默症患者的益处超过了风险,出于这样的考虑,FDA在最后的时间节点才最终宣布,批准该药上市。
不过,在加速审批条款下,FDA要求渤健公司进行一项新的随机、对照临床试验,以验证该药物的临床效益。如果试验未能证实临床益处,FDA可能会启动程序撤销对该药物的批准。
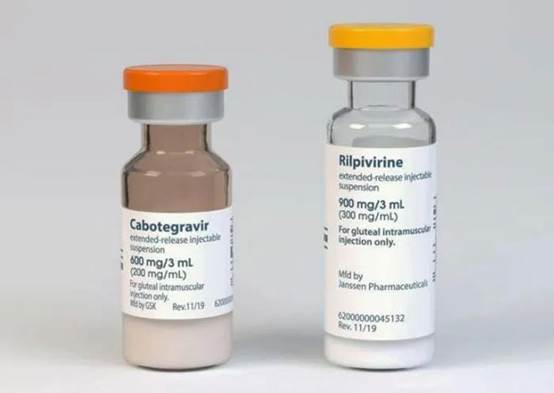
2、首个HIV成年患者的完整长效方案:Cabenuva
2021年1月,由强生公司旗下杨森制药与知名艾滋病治疗企业ViiV Healthcare合作开发的Cabenuva获得FDA批准,以取代传统的抗逆转录病毒方案,用于治疗感染了人类免疫缺陷病毒1型(HIV-1)的成人患者。Cabenuva是一种每月一次、双药注射组合疗法,由长效HIV整合酶抑制剂卡博特韦(Cabotegravir)和非核苷逆转录酶抑制剂利匹韦林(Rilpivirine)组成,一年只需12次肌肉注射,就能有效抑制HIV-1病毒增殖。
Cabenuva 的批准上市,被业内称为是艾滋病治疗的革命。这是用于成人治疗HIV-1感染的第一个也是唯一一个完整长效方案。患者仅需每月接受一次治疗,就能达到抑制病毒的效果。Cabenuva的上市将全年每天365天口服转变为每月注射一次全年仅需注射治疗12天。
3、第一个治疗狼疮肾炎口服疗法:Lupkynis
2021年1月,Aurinia制药公司宣布FDA批准Lupkynis(voclosporin,伏环孢素)联合免疫抑制疗法治疗成人活动性狼疮肾炎,这是美国FDA批准的第一个治疗狼疮肾炎口服疗法。
狼疮肾炎是系统性红斑狼疮最严重的并发症之一,如果控制不佳,会导致永久性和不可逆的肾脏损伤,显著增加肾脏衰竭、心血管事件和死亡风险。
但狼疮肾炎一直缺乏有效治疗的药物。2020年12月,GSK开发的贝利尤单抗新适应症获批,用于正在接受标准疗法的狼疮肾炎患者,是FDA批准的首个用于治疗狼疮肾炎的药物。而伏环孢素则是FDA批准的首个专门用于治疗狼疮肾炎的口服疗法。
4、新一类治疗外阴阴道念珠菌病药:Brexafemme
2021年6月,Scynexis公司宣布,公司新型广谱抗真菌药物Brexafemme已获FDA批准,用于治疗外阴阴道念珠菌病女性患者。Brexafemme是全球首创的广谱三萜类抗真菌剂,是治疗外阴阴道念珠菌病的第一个也是唯一一个口服非唑类药物,仅需服药一天,能够解决广泛疾病严重程度的阴道酵母菌感染。
外阴阴道念珠菌病俗称念珠菌引起的阴道酵母菌感染,是第二常见的阴道炎病因。虽然这些感染通常是由白色念珠菌引起的,但氟康唑耐药的念珠菌菌株,如光滑念珠菌,已经被报道越来越普遍。外阴阴道念珠菌病可导致严重的发病率,包括严重的生殖器不适、性快感降低、心理痛苦和生产力丧失。据估计,全世界70-75%的女性一生中至少会有一次外阴阴道念珠菌病发作,40-50%的女性会经历两次或两次以上外阴阴道念珠菌病发作。
但外阴阴道念珠菌病治疗方案有限,此前仅有一类产品(唑类)和一种口服产品(氟康唑)。因此,该药物是女性健康领域抗真菌感染的重大突破,也是20多年来首个获批的全新作用机制的第四代抗真菌类药物。
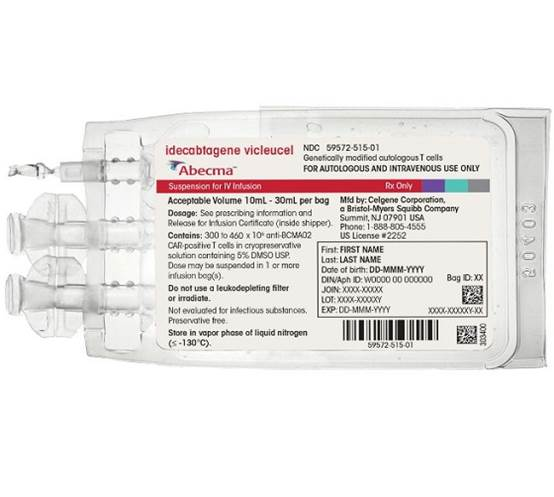
5、首个靶向BCMA的CAR-T疗法:Abecma
2021年3月,百时美施贵宝和蓝鸟联合宣布双方共同研发的靶向BCMA的CAR-T细胞产品Abecma正式被FDA批准上市销售,适应症为成年患者接受过四种以上前期疗法的复发/难治性多发性骨髓瘤。这是首个获FDA批准上市的靶向BCMA的CAR-T疗法。
此前上市的几款CAR-T产品均靶向CD19。CAR-T细胞疗法又叫嵌合抗原受体T细胞疗法,是近年来推出的新型精准靶向治疗肿瘤细胞技术。在实验室,技术人员通过基因工程技术,将T细胞激活,并装上定位导航装置CAR(肿瘤嵌合抗原受体),即CAR-T细胞,他利用其“定位导航装置”CAR,专门识别体内肿瘤细胞,并通过免疫作用释放大量的多种效应因子,高效地杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。
6、首个治疗子宫内膜癌的PD-1:Jemperli
2021年4月,美国FDA宣布批准抗PD-1抗体Dostarlimab(Jemperli)上市,用于治疗复发或晚期子宫内膜癌患者。这是FDA批准的首个治疗子宫内膜癌的抗PD-1疗法。
子宫内膜癌是一种发生于子宫内膜的癌症,是影响女性生殖器官的最常见癌症类型,是全球女性第六大常见癌症。大约75%的子宫内膜癌是在早期诊断的,通常可以通过手术治愈。然而,晚期和复发性子宫内膜癌的女性在接受含铂化疗方案的一线标准治疗后,治疗选择有限。
Jemperli是一款人源化抗PD-1单克隆抗体,与PD-1受体结合,并阻断其与配体PD-L1和PD-L2的相互作用。该药通过靶向PD-1/PD-L1的细胞途径发挥作用。Jemperli通过阻断这一途径帮助人体免疫系统对抗癌细胞。
数据来源:药智数据、药智咨询整理;Drugs@FDA
图片来源:网络整理
文章来源:药智网、健康时报整理
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略

















评论
加载更多