血液制品分装器具清洁方法比对分析
本文对比分析了血液制品生产过程中除菌分装工序常用器具清洁方法的清洁效果。评估选取分装器具模拟污染物及器具,采用手工清洁和自动清洗机清洁两种清洁方法,通过器具目检,淋洗水澄清度、pH、电导率、总有机碳(TOC)、细菌内毒素、微生物限度和不溶性微粒检测,评估不同清洁方法清洁后的器具清洁效果,并对不同清洁方法的特点进行比对分析。结果显示,自动清洗机清洁和手工清洁的检测结果均符合可接受标准,但自动清洗机的清洁效果更好,且过程自动化,数据能够实时采集和共享。然而,对于不适用清洗机的部分器具,仍需采用手工清洁,以确保血液制品所用分装器具均能得到有效清洁。
血液制品是指从健康人血浆中通过分离纯化等方式提取的血浆蛋白制品[1]。按照药品生产质量管理规范(GMP)的要求,血液制品生产过程中使用的器具应进行及时、有效、彻底的清洁。分装用具作为直接接触制品的器具,其清洁效果对药品质量至关重要。
目前,血液制品生产企业常用的清洁方法包括手工清洗和清洗机自动清洗。随着国家药监局综合司关于印发血液制品生产智慧监管三年行动计划(2024—2026 年)的启动,推动在2026 年底前基本实现血液制品生产信息化管理 [2],器具自动清洁设备将逐步取代传统的手工清洁,广泛应用于血液制品行业。根据《清洁验证技术指南》的要求,有效的清洁工艺能够将生产设备及部件中的残留物,如残留产品(降解产物)、清洁剂及微生物等,清除至可接受水平,使之符合药品生产要求,并形成有效证明文件 [3]。自动清洁方式可实现对自动清洁程序及其参数(如时间、流速、压力、清洁剂浓度、温度)进行稳定可靠地运行、控制及监控等,保证清洁效果的有效性和清洁程序的重现性。
为确保实际生产过程中分装器具的有效清洁,本文对比分析了手工清洁与自动清洗机的清洁效果和清洁特点。基于现行法规及指导原则、产品特性及生产工艺等因素,为制药企业分装用具的清洁选择提供了理论参考,旨在进一步提升生产效率和保障产品质量。
Part1 材料与方法
1.1材料与设备
试验所需设备包括:器具清洗机(型号:P1200 型,天津语瓶仪器技术有限公司)、多参数仪(型号:S470型,梅特勒)、总有机碳检测仪(型号:M9,GE)、微粒分析仪(型号:GWFDS1,天津天河分析仪器有限公司)、澄明度检测仪(型号:YB-3,天津市博宇伟业科技有限公司)、水浴箱(型号:BWS-27 型,一恒)、MF 显微细胞圈分析 / 菌落计数 / 筛选 / 抑菌圈测量联用仪(型号:MF4,杭州迅数科技有限公司)。
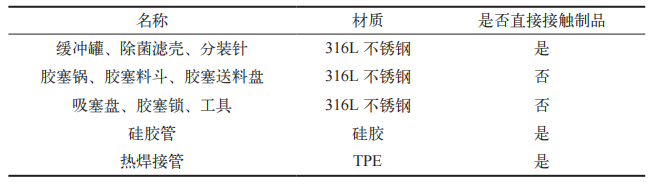
试验所需材料包括:氢氧化钠(溶液浓度:50%,成都市科隆化学品有限公司)、注射用水、血浆瓶(规格:250 mL,蜀牛玻璃仪器有限公司)、中硼硅玻璃模制注射剂瓶(规格:50 mL,药用铝箔纸封口,山东药用玻璃股份有限公司)、无菌取样袋(比克曼)、人血白蛋白(规格:10 g/50 mL,国药集团兰州生物制药有限公司)。根据血液制品除菌分装工序列出需清洁的所有使用器具,详见表 1。
表 1 清洁器具统计
1.2试验方法
为验证血液制品分装器具的清洁有效性,并明确符合规范的清洁工艺与检测标准,本试验依次确定了清洁方法、模拟污染物及器具选择原则、污染与清洗试验流程,以及关键质量指标的检测方法,以下为具体内容。
1.2.1清洁方法
本试验采用手工清洁与自动清洗机两种清洁方式,具体操作流程及设备参数如下:
手工清洁:在清洗池内,手动隔膜阀门至少开一圈半,手握降温注射用水(温度设定为 25℃)出水硅胶管末端,对器具充分冲洗至少三遍,每遍冲洗时间不少于 20 s ;
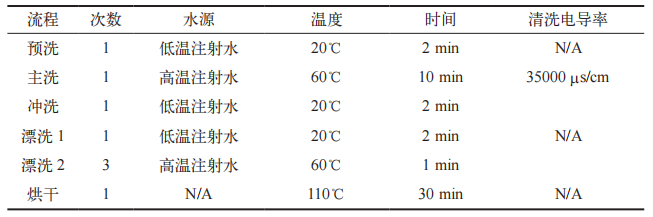
自动清洗机:工作原理是清洗水(包括高温注射用水和低温注射用水)通过进水管路进入清洗机内腔,当达到相应进水量后,卫生级循环泵启动,带动清洗水进行循环。清洗水通过管路进入清洗架,通过清洗架的喷淋球、喷管等部件对待清洗器具进行喷射清洗。在清洗过程中,通过加液泵向清洗水中泵入清洗液,同时设备安装有电加热管对清洗水加热,以达到清洗洁净的目的。清洗结束后,清洗水通过排水系统排放至公共排水管道,设备启动热风干燥程序。风机启动,将外界风吸入,通过电加热器对常温风进行加热,然后热风经过高效过滤器进入内腔及清洗架,对清洗的器具进行热风干燥。同时,进入的热风通过排风管道排放至外界。自动清洗机的清洁程序及设备使用参数见表 2。
表 2 器具自动清洗机清洗程序及参数
1.2.2分装器具模拟污染物及器具选取评估
血液制品根据成分不同,主要分为白蛋白、免疫球蛋白及凝血因子等类型。分装器具接触的水溶性较低物料主要为蛋白质,其中人血白蛋白的蛋白质含量为 200 g/L,蛋白质浓度为 20%,其蛋白浓度最高,残留量更多,清洁难度更大。因此,选取人血白蛋白作为清洁方法模拟的污染物,人血白蛋白生产使用的除菌分装器具作为目标清洁器具。
1.2.3分装器具模拟污染及清洗试验方法
取 200 g/L 的人血白蛋白溶液置于喷壶中,均匀喷涂至待清洁器具的内表面和外表面。污染 1 h 后,分别进行手工清洁和自动清洗机清洁。清洗结束后,取最终淋洗水进行检测。为确保检测结果的可靠性和安全性,每种清洁方式重复三次。
1.2.4检测方法
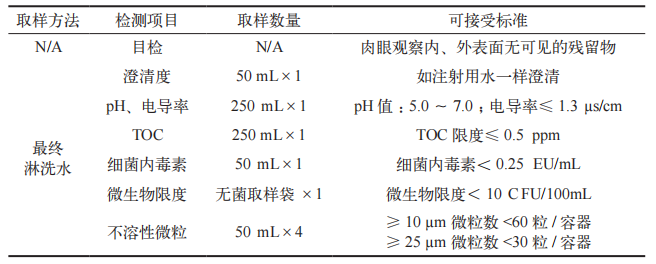
采用澄明度测试仪、多参数仪、总有机碳检测仪、MF 显微细胞圈分析 / 菌落计数 / 筛选 / 抑菌圈测量联用仪、微粒分析仪,分别对最终淋洗水进行澄清度、pH 值、电导率、TOC、微生物限度及不溶性微粒的检测。取样方法、检测项目、取样数量及可接受标准见表 3。
表 3 取样方法、检测项目、取样数量及可接受标准
Part2 结果分析
2.1器具及最终淋洗水检测结果
为全面评价清洁效果,依次对清洁后器具进行外观检查、最终淋洗水澄清度及关键质量属性检测,具体结果如下。
2.1.1器具目检
通过目检手工清洁和清洗机清洁后的分装器具,发现其内表面和外表面均无可见残留物。手工清洁后的不锈钢缓冲罐、滤壳等表面,以及硅胶管、热焊接管和分装针管道内部,均残留少量注射用水。而经自动清洗机清洁并烘干后的器具,其内表面和外表面均无残留注射用水。
2.1.2澄清度检查
手工清洁和自动清洗机清洁后的分装器具最终淋洗水样经透检后均显示无可见异物,水质如注射用水般澄清,符合生产要求。
2.1.3最终淋洗水样其他检测结果
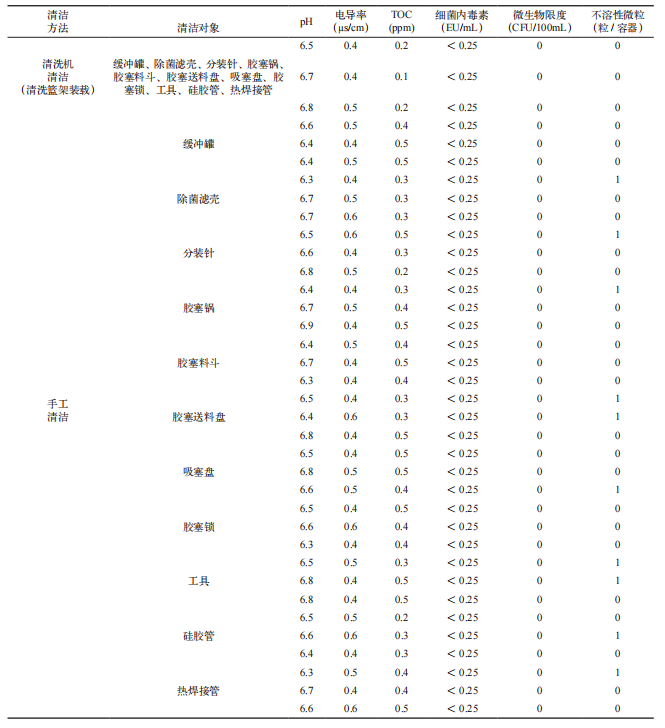
手工清洁和自动清洗机清洁后的分装器具最终淋洗水样的 pH 值、电导率、总有机碳(TOC)、细菌内毒素、微生物限度及不溶性微粒检测结果如表 4 所示。两种清洁方式的最终淋洗水样检测均符合可接受标准。其中,TOC、电导率及不溶性微粒的检测结果显示,自动清洗机的清洁效果明显优于手工清洁。使用自动清洗机清洁后的分装器具淋洗水中蛋白质残留更少,清洁效果更佳。
表 4 最终淋洗水样检测结果
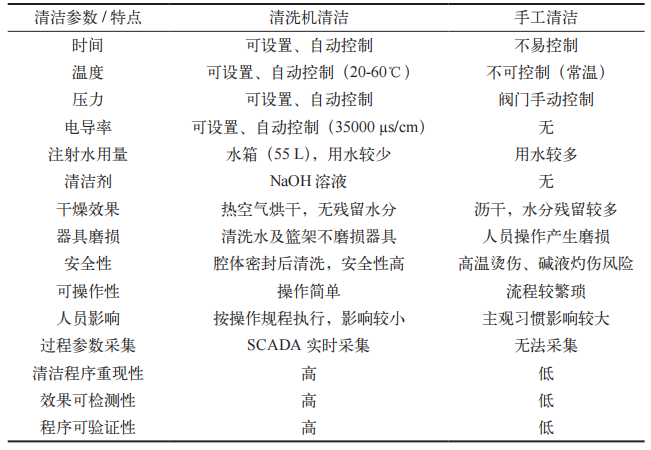
2.2清洗机清洁与手工清洁特点对比分析
通过对比自动清洗机和手工清洁的清洁时间、温度、压力等多方面参数,分析清洗机清洁与手工清洁的特点如表5所示。器具清洗机清洗参数可设置,清洁过程自动运行,人员客观因素影响较小,设备操作简单、安全,清洁效率高,淋洗水取样数量少,检测方便,且运行全过程关键参数可实时采集形成曲线,清洁程序具有重现性和可验证性。手工清洁方式流程较繁琐,效率低,用水量无法合理控制,清洁过程受操作人员客观习惯影响较大,并有损坏器具的潜在风险,其清洗过程无法在线记录,不能满足智慧监管的要求,手工清洁程序重现性较差、可验证性较低。
表 5 清洗机清洁与手工清洁特点
Part3 讨论
在健康中国战略深入推进的背景下,打造集自动化、信息化、智能化于一体的血液制品生产链显得尤为紧迫。随着我国装备制造与人工智能产业的快速发展,医药生产领域涌现出众多新型装备,设备性能不断提高。其中,器具清洗机为药品生产用器具的清洁带来了创新方法和更为高效的清洁效果。该设备能够根据不同企业、不同产品所用器具的特点,定制专用清洗篮架,确保所有器具无清洁死角,并能同时清洁多个器具。通过合理设置参数(如温度、压力、时间、次数、电导率等)并进行验证,可编辑出一套稳定、可靠的清洁程序。器具清洗机的主洗步骤在高温注射用水(60℃)中加入 NaOH 溶液,使清洗水电导率达到 35000 µs/cm,此时清洗水中 NaOH 浓度约为 1%[4],高温 NaOH溶液具有良好的杀灭热原效果。生产使用后的用具经清洗机清洁后,再由设备涂碱程序处理并保存,可有效抑制热原生长 [5]。清洗步骤结束后,设备自动执行干燥程序,确保所有不锈钢器具表面,硅胶管及热焊接管内外表面均无残留水分,为器具组装后湿热灭菌干燥效果提供坚实保障。
对于需清洁的器具,应优先选用清洗机进行自动清洁。对于不适合清洗机清洁的器具,则可采取手工清洁方式。某些物品不适合使用清洗机进行清洁,例如内部结构复杂的器具,其清洁死角难以触及;材质较软的器具,如 RABS 手套,无法通过器械对其内外表面进行充分清洁,且存在损坏风险;不耐高温、不耐碱的物品也无法进行机器清洁。此时,应充分发挥手工清洁灵活性强的优势,对上述器具进行细致清洁。在进行手工清洁前,须制定完备可靠的操作规程,对执行人员进行系统培训,加强对清洗过程的监督,并及时检测清洁效果,确保手工清洗效果符合 GMP 要求。
为保障器具清洗后的清洁效果不受破坏,应在器具清洗机出料门处设置 A级层流保护罩。洁净的器具在层流保护下进行组装,组装时人员不得直接接触器具关键部位。组装后的器具(如缓冲罐,除菌滤器等)应装入双层呼吸袋并封口,从 A 级层流转移至蒸汽灭菌器进行湿热灭菌。灭菌后的器具应转移至 A级层流或 A 级延展层流环境下,方可拆除呼吸袋进行组装或使用。
血液制品生产企业应根据自身厂房、设施、设备、生产工艺等特点,以及相关法规和指导原则的要求,制定科学的器具清洁程序,选择合适的清洁方法,在保证产品质量的同时,提高效率,减少能耗。
参考文献
[1] 倪道明. 血液制品[M]. 北京:人民卫生出版社,2013:91.
[2] 国家药品监督管理局. 国家药监局综合司关于印发血液制品生产智慧监管三年行动计划(2024—2026年)的通知:药监综药管函〔2024〕295号[EB/OL]. (2024-06-11)[2025-07-14]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20240611172005178.html.
[3] 国家药品监督管理局食品药品审核查验中心.清洁验证技术指南[EB/OL]. (2025-01-17)[2025-07-14]. https://www.cfdi.org.cn/cfdi/resource/news/16299.html.
[4] 陆子健,李成梁,李帅,等. 氢氧化钠标准溶液浓度标定方法的比较研究[J]. 哈尔滨师范大学自然科学学报,2019,35(01):78-83.
[5] 石小红,武正琼,邹旭,等. 不同浓度的氢氧化钠溶液不同方式除热原效果的验证及过程控制的研究[J]. 山东化工,2023,52(7):21-23.
邵丽竹
何发
相关推荐
-
酒黄精中药饮片炮制工艺改进研究进展
酒黄精在现行的《中国药典》2020 年版一部虽有收载,但并未对炮制工艺参数作出具体规定,导致酒黄精饮片生产炮制工艺标准不统一,市面上酒黄精饮片质量存在显著差异,尤其是黄精多糖的含量极易不合格。
2025-12-25 陈佳祺
-
水系统中的红锈是怎么产生的?
红锈是制药用水系统(特别是高温循环的注射用水系统)中一种常见且棘手的腐蚀现象,其产生源于材料、设计、制造(焊接、钝化)、运行(氧、氯、流速)、维护等多方面因素。
2025-12-24 GMP设备与工艺验证、Equipment group
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多