清洁可接受限度计算方法探讨
在清洁验证中,活性物质残留限度标准应基于产品毒理试验数据或毒理学文献资料,并结合实际生产情况建立。传统方法设定限度通常采用最低日治疗剂量的 1/1000、10 ppm 等方法。相较于传统方法,基于健康的暴露限度(HBEL)的可接受标准(如 PDE 值)在评估清洁残留数据时更具科学性和优势。本文介绍了南京正大天晴制药有限公司 ( 以下简称“我司”)固体制剂(抗肿瘤药)车间清洁可接受限度方法建立的案例。
Part1 引言
国家药品监督管理局食品药品审核查验中心(CFDI)于 2021 年 11 月 2日发布关于公开征求《药品共线生产质量管理指南(征求意见稿)》意见的通知,并于 2023 年 3 月 6 日正式发布《药品共线生产质量风险管理指南》[1]。
该指南指出,活性物质残留限度标准应基于产品毒理试验数据或毒理学文献资料,并结合实际生产情况建立,且需在产品生命周期内进行定期评估。评估过程应遵循 HBEL、毒理学研究数据等制定策略,并记录评估过程,包扩但不限于物质毒理危害的识别、阈剂量的获取、PDE 计算过程校正因子的选择、用于识别危害的参考文献或原始试验数据等。相对于传统方法(如最低日治疗剂量 1/1000、10 ppm 方法等)设定的限度,基于健康的暴露限度(HBEL)的可接受标准(如 PDE 值)在评估清洁残留数据时更具科学性和优势 [2]。
Part2 问题引入
我司建有固体制剂(抗肿瘤药)车间,用于固体制剂(抗肿瘤药)的生产,目前有 2 个品种在生产。对于大多数化合物,传统限度值相对于 PDE 值较为严格,但是对于某些抗生素类、细胞毒类抗肿瘤药物或高活性产品,传统限度值可能会超过 PDE 值。如果采用传统方法设定的限值,可能无法充分保护患者免受长期暴露的风险 [3]。
《药品生产质量管理规范》附录11 :确认与验证中第四十二条也有相应规定:活性物质残留限度应基于毒理学试验数据或毒理学文献资料的评估建立 [4]。
目前, 我司固体制剂(抗肿瘤药)生产线清洁验证活性物质残留可接受限度采用传统方法计算,即基于最低日治疗剂量 1/1000 和基于分析方法 10 ppm 计算,并选择最严格的限度1.66 μg/cm2 作为清洁可接受限度。而基于健康的暴露限度(HBEL)的计算方法尚属缺失。
Part3 国内外资料查询
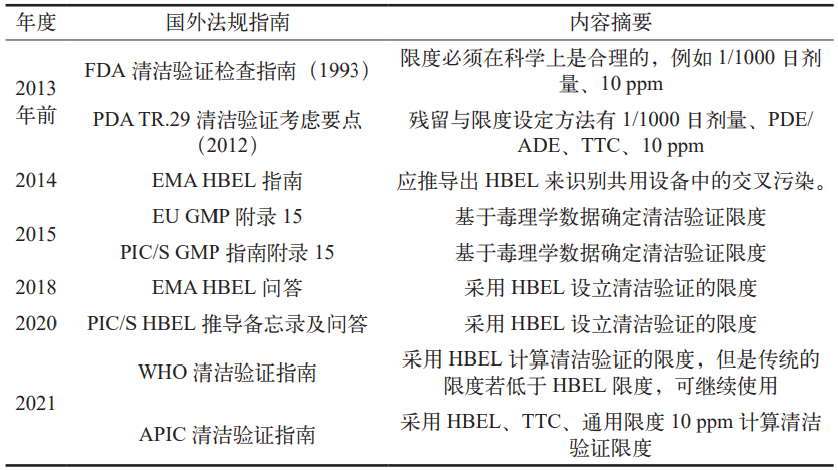
本文对国内外法规指南进行了查询与借鉴,分析结果如表 1 和表 2 所示。通过系统性地查阅国内外相关指南及文献资料,发现目前绝大多数行业指南均推荐优先采用基于健康的暴露限值(HBEL)来计算活性物质残留限度 [5-6]。
表 1 历年国内法规指南摘要
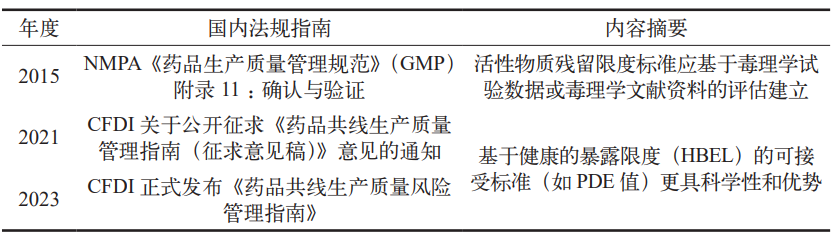
表 2 历年国外法规指南摘要
Part4 基于健康的暴露限度(HBEL)计算方法建立
HBEL 应计算为每日可接受暴露量(ADE)或每日允许暴露量(PDE)。基于健康的暴露限度(HBEL)的可接受标准(如 PDE 值)在评估清洁残留数据时更具科学性和优势。
PDE 指的是药物或产品每日可接受的最大摄入量。PDE 的确定基于大多数相关动物研究中的未观察到作用水平(NOEL)或观察到作用的最低水平(LOEL)。
4.1 NOEL、LOEL 数据查询方法的建立
对于绝大多数仿制药而言,国内外企业均已具备成熟的毒理学研究数据。可以通过咨询公司购买毒理学数据完整的 HBEL 数据,通过 FDA、EMA、PMDA 等官方网站查询药品注册审评文件资料,以获取药理毒理数据。具体信息如下:
FDA 查询:登录 FDA 官方网站https://www.fda.gov/,搜索药品名称,获取药物审评文件(FDA ApplicationFiles),下载药理学审评(PharmacologyReview)文件,从中读取相关毒理数据;
EMA 查 询:登 录 EMA 官 方网 站 https://www.ema.europa.eu/en/homepage,搜索药品名称,获取审评报告(Assessment report),从中获取相关毒理数据;
日本药监局:登录日本医疗器械审评审批机构(PMDA)网站 https://www.pmda.go.jp/,进入医疗用药品链接,检索药品名称,获取药品采访表,从中获取相关毒理数据;
其他:也可以通过欧洲化学品管理局、美国环保署等其他网站查找相关毒理数据。
4.2 NOEL、LOEL 数据查询
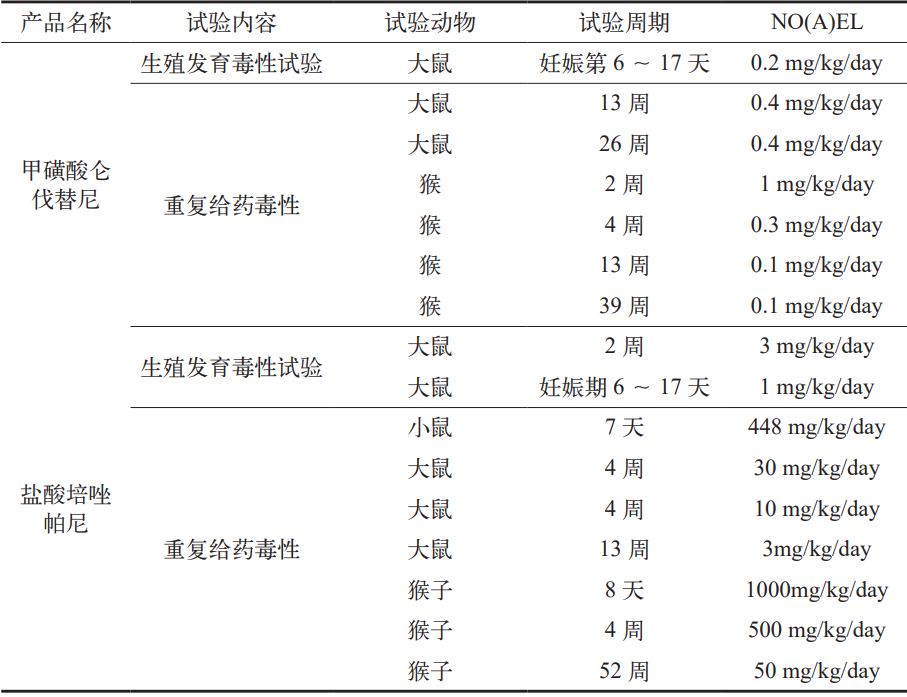
通过以上官方毒理学文献资料,对我司固体制剂(抗肿瘤药)车间进行了相关毒理数据查询工作,数据汇总如表3 所示。
表 3 我司固体制剂(抗肿瘤药)车间相关毒理数据汇总
4.3 PDE 计算方法建立
参照《ICH Q3c :残留溶剂的指导原则》中的示例,每日允许暴露量(Permitted Daily Exposure, PDE)是指药物或产品每日可接受的最大摄入量。PDE 是基于大多数相关动物研究中的未观察到作用水平(NOEL)或观察到作用的最低水平(LOEL)计算得出的,其计算公式如下:
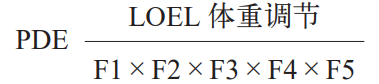
式中:体重调节(Weight Adjustment)一般取 50 kg ;F1 为考量物种间差异的因子,具体选择如表 4 所示;F2 是考虑个体差异的因子,在药物允许残留限度的计算中统一采用 10 ;F3 为考虑短期暴露毒性研究的可变因子,具体选择如表 5 所示。对研究时间介于上述时间点之间的研究应用较大的因子,例如,对为期 9 个月的啮齿动物毒性研究采用因子 2 ;F4 在非遗传毒性致癌性、神经毒性或致畸性等严重毒性情况下使用,生殖毒性研究中采用的因子详见表 6 ;F5是未确定无反应水平时可应用的可变因子。当仅有LOEL(最低观察到效应水平)可用时,根据毒性的严重程度,可以使用高达 10 的因子 [7]。
表 4 F1 的具体选择
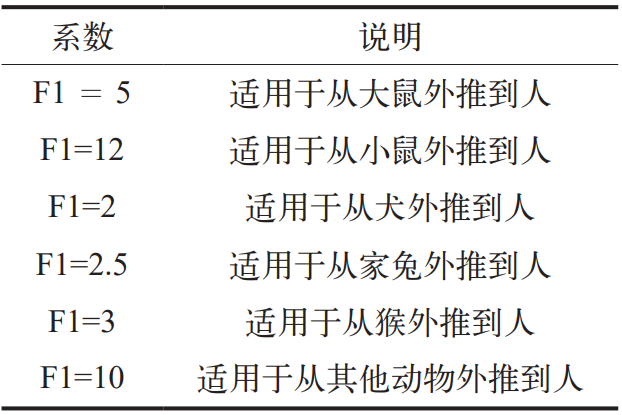
表 5 F3 的具体选择
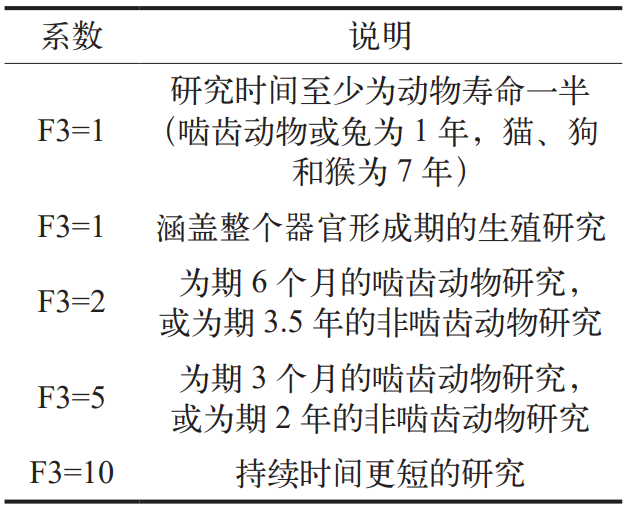
表 6 F4 的具体选择

PDE 值的选择标准为当计算出多个每天允许暴露量(PDE 值)时,应选取最低的 PDE 值,用于清洁验证允许残留限度的计算。
4.4 PDE 数据计算
根据计算公式及风险因子赋值,对我司固体制剂(抗肿瘤药)车间的两个产品进行了计算,得出各活性成分的允许日接触剂量(PDE),具体结果如表 7 所示。此外,从上述计算得出的各试验结果 PDE 值中,选取了共线产品活性成分的最小 PDE 值,如表8 所示 [8]。
表 7 我司固体制剂(抗肿瘤药)车间的两个产品的各活性成分的允许日接触剂量(PDE)
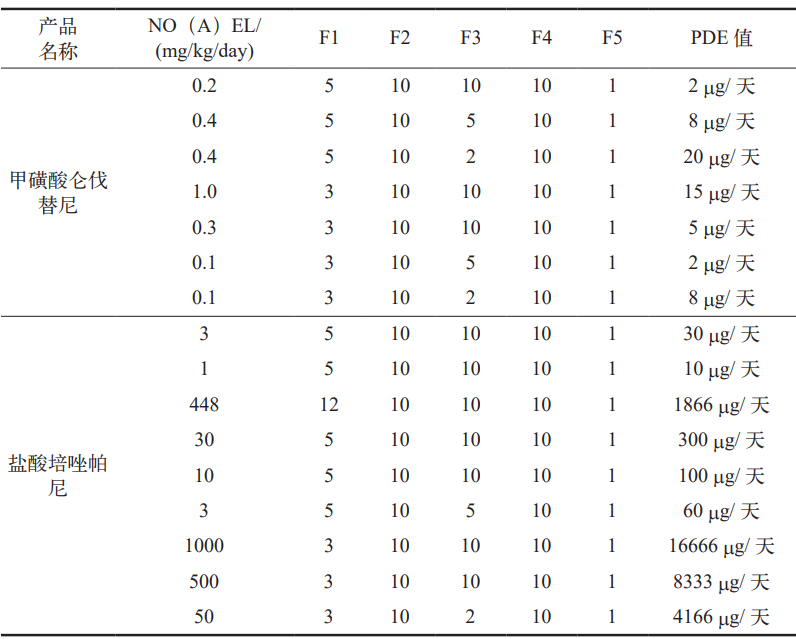
表 8 选择共线产品活性成分的最小 PDE 值

4.5 清洁可接受限度计算方法升级
传统的清洁残留可接受限度计算方法主要包括最低日治疗剂量的1/1000 以及 10 ppm 两种(见表 9 和表10)。新的清洁残留可接受限度计算方法在此基础上进行了改进,增加了基于健康暴露限度(HBEL)的计算,以约定允许的清洁可接受残留限度(见表 10)。
表 9 基于最低日治疗剂量的 1/1000 以及 10 ppm 的计算结果
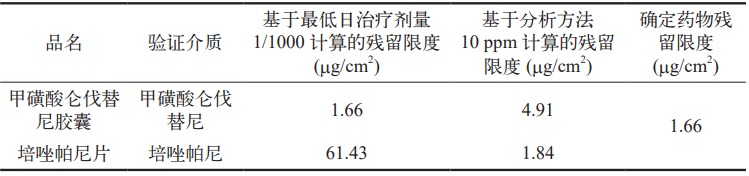
表 10 基于健康暴露限度(HBEL)的计算结果
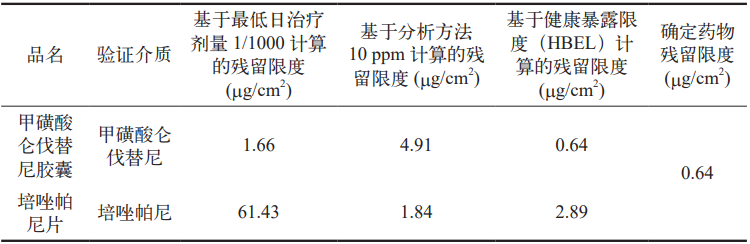
Part5 结论
我司固体制剂(抗肿瘤药) 车间清洁工作已建立了全新的清洁残留可接受限度(HBEL)计算方法。该方法包括最低日治疗剂量的 1/1000、10 ppm 以及 HBEL 三种计算方式,并选取其中最小值,从而形成了更为严格的清洁残留可接受限度。针对新设定的限度,已全面开展清洁验证工作,有效降低了交叉污染风险,确保用药患者的安全,并对患者长期暴露提供充分保护。
参考文献
[1] 中华人民共和国药品管理法[EB/OL]. (2019-08-26). https://www.nmpa.gov.cn/yaopin/ypfgwj/ypflxzhfg/20190827083801685.html.
[2] 中华人民共和国卫生部 . 药品生产质量管理规范 (2010 年修订 )[S]. 卫生部令第 79 号 . 2011.
[3] 国家药品监督管理局食品药品审核查验中心 . 药品 GMP 指南:第2 版 [M]. 北京 : 中国医药科技出版社 , 2023.
[4] 国家药品监督管理局食品药品审核查验中心 . 关于发布《药品共线生产质量风险管理指南》的通告 [EB/OL]. (2023-03-06). https://www.cfdi.org.cn/cfdi/resource/news/15186.html.
邵丽竹
何发
相关推荐
-
水系统中的红锈是怎么产生的?
红锈是制药用水系统(特别是高温循环的注射用水系统)中一种常见且棘手的腐蚀现象,其产生源于材料、设计、制造(焊接、钝化)、运行(氧、氯、流速)、维护等多方面因素。
2025-12-24 GMP设备与工艺验证、Equipment group
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多