浅析胶囊用牛骨明胶生产企业批生产记录管理
本文旨在深入探究胶囊用牛骨明胶生产企业批生产记录管理的重要性、要求、常见问题以及优化策略,为当前胶囊用牛骨明胶生产企业进行批生产记录管理提供方法。本文从当前国际和国内相关法律法规要求入手,分析了胶囊用牛骨明胶生产企业批生产记录管理中存在的风险和困难,并提出相应的风险控制措施。结果批生产记录的管控措施切实有效,可实现规范管理。得出的结论是胶囊用牛骨明胶生产企业如果能从文件管理和记录管理两方面做好批生产记录管理,便能降低胶囊用牛骨明胶的质量风险,生产出符合注册和监管要求、质量可控且安全的胶囊用牛骨明胶。
Part1 引言
胶囊用牛骨明胶作为药用辅料,鉴于疯牛病 [1] 等风险会对人类健康和生命安全造成影响,其生产过程必须接严格的监管和控制。在胶囊用牛骨明胶生产企业中,批生产记录管理是质量保证体系的重要组成部分,它涵盖了从原材料采购到成品放行的全过程,为药品的质量追溯、工艺优化和法规合规提供了关键的证据支撑。
批生产记录 [2] 是胶囊用牛骨明胶生产企业记录管理中的重点。记录是阐明所取得的结果或提供所完成活动的证据的文件 [3]。文件是信息及其载体 [3],空白记录通常按照文件进行管理。因此,记录管理分为文件(空白记录)管理和记录管理两部分。由此,胶囊用牛骨明胶生产企业批生产记录管理也分为文件管理和记录管理两部分。
胶囊用牛骨明胶生产企业批生产记录能记载每一批胶囊用牛骨明胶生产的真实情况,因此批生产记录在质量管理中显得尤为重要 [4]。
Part2 胶囊用牛骨明胶生产企业批生产记录管理的重要性
《中华人民共和国药品管理法》《药品生产质量管理规范》《药物警戒质量管理规范》[5-10] 以及《IPEC-PQG 药用辅料生产质量管理规范指南》[11] 等法律法规,均对记录管理作出了明确规定。
2.1文件管理
胶囊用牛骨明胶生产企业建立了《文件控制程序》,用于文件的设计、制定、审核、批准发放、使用、修订、回收归档和销毁管理。如果文件需要修订时,相关部门需要提出申请,经批准后进行修订,再经过审核、批准和发放方可使用;如果文件已不适用,则需回收,原版文件进行归档管理,复印件作销毁处理。
2.2记录管理
胶囊用牛骨明胶生产企业建立了《记录控制程序》,用于记录的填写、标识、贮存、保护、检索、保存期限、处置以及电子记录的管理。
2.3记录管理的重要性
2.3.1保障胶囊用牛骨明胶质量和安全性
填写准确、完整的批生产记录,作为重要资料,有助于确保胶囊用牛骨明胶生产过程的一致性和稳定性,及时发现潜在的质量问题,并采取有效的纠正措施。
2.3.2符合法规要求
药品监管机构对胶囊用牛骨明胶生产企业的记录有明确的规定,良好的记录管理是企业合规运营的必要条件。
2.3.3支持质量追溯
当胶囊用牛骨明胶出现质量问题时,可通过记录迅速追溯到问题源头,确定责任并采取召回措施。
2.3.4促进持续改进
胶囊用牛骨明胶批生产记录为优化工艺、提高生产效率和降低成本提供依据。
Part3 胶囊用牛骨明胶生产企业批生产记录管理的要求
3.1真实性、准确性和客观
批生产记录必须如实反映生产过程中的实际情况,数据不得伪造和篡改。
3.2完整性
批生产记录应涵盖所有关键生产环节和质量控制要点,不得遗漏。
3.3清晰、易读、不易擦除
批生产记录书写应规范、字迹清晰,易于理解和查阅。
3.4可追溯性
批生产记录应具备可追溯性,即能从客户溯源到直接供应商,也能从供应商追踪到直接客户,覆盖整个过程的各个环节。
3.5保存期限
企业应按照法规要求,妥善保存记录一定时间。
Part4 记录管理的常见问题与优化策略
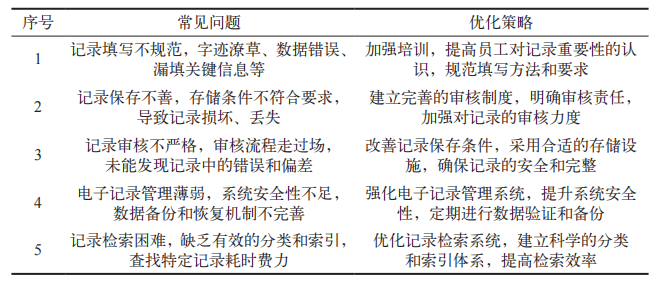
某胶囊用牛骨明胶生产企业,员工起初用铅笔填写记录,这种方式极易被擦除;随后改用蓝色圆珠笔填写,但时间一长,记录容易褪色;接着又换成黑色中性笔填写,然而原始记录却被客户误认为是复印件,于是又改为用蓝色中性笔填写。该胶囊用牛骨明胶生产企业的批生产记录经常面临挑战。记录管理的常见问题与优化策略详见表 1
表 1 记录管理的常见问题与优化策略
Part5 胶囊用牛骨明胶生产企业批记录管理的实例分析
以某知名胶囊用牛骨明胶生产企业为例,详细介绍其在记录管理方面的成功经验,包括完善的记录流程、先进的电子记录系统以及严格的审核机制等。
某胶囊用牛骨明胶生产企业制定了《文件控制程序》和《记录控制程序》,用于批生产记录的管理。
批生产记录均由工艺员编写、经工艺主管、生产主管审核,再由生产经理批准后使用。
半成品生产计划单由工艺员填写,工艺主管审核,生产经理批准;领料单,由生产班长填写,工艺员审核,生产主管批准;各工序生产记录,由工序操作人员填写,班长审核,主管批准;清场记录和关键控制点记录由工序操作人员填写,经班长、现场品管和生产主管审核,生产经理批准;物料平衡记录由工艺员填写,工艺主管审核,生产经理批准。
成品生产工单由 PMC 专员编写,PMC 主管审核,质量经理批准。领料单由生产班长填写,PMC 专员审核,PMC 主管批准;各工序生产记录和清场记录由工序操作人员填写,班长审核,主管批准;关键控制点记录由工序操作人员填写,班长和现场品管审核,PMC 批准。物料平衡记录由生产班长填写,PMC 专员审核,PMC 主管批准。
清场记录、关键控制点记录、物料平衡记录以及偏差处置记录,最终都需由 QA 主管再次审核,以此作为产品是否放行的依据。
5.1文件管理
胶囊用牛骨明胶生产企业制定了《文件控制程序》以对文件进行管理。该文件控制程序主要规定了文件编写,文件审核、文件批准、文件复制分发、文件修订以及文件撤销等环节。文件管理流程详见图 1。
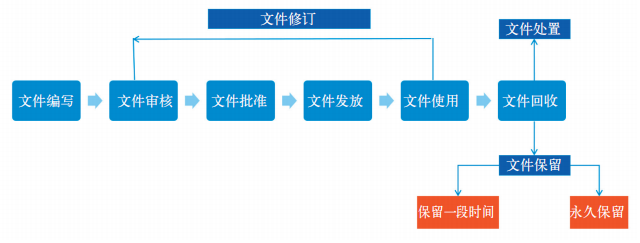
图 1 文件管理流程图
其中,批生产记录包括生产计划单、领料单、各工序生产记录表、物料平衡记录表、生产偏差处理记录以及最小销售包装的标签 [12-13]。文件管理流程详见图 1。
5.1.1文件编写
文件由使用部门按照《文件控制程序》的规定进行编写,保证文件实用、全面且准确,同时符合《文件控制程序》的要求。编写人员需按程序及时向文控中心索取文件编码。文件编写完成后,由使用部门负责人进行审核。
记录策划方面,每个记录应设有表头和编号,以便与其他生产记录相区分;要确保每个记录的上下工序链接良好,保证具有可追溯性;需涵盖工序所有需要记录的信息;要与操作规程保持一致;一份生产记录空白表,既要为操作员工提供足够的填写空间,又要保证空格之间存在一定的逻辑关系(明确先记录什么,再记录什么,最后记录什么);一份生产记录空白表,能采用选项的就不填写文字,即能打“√”和“×”的就不填写;能填写“数据”的就不填写“数据 + 单位”;能用位数少的数据就不用位数多的数据;虽然信息要详细、齐全,但应尽量在一张表格中策划好所有需要记录的信息,避免拆分为多张表格,防止重复记录。
5.1.2文件审核
文件需由使用部门负责人进行审核。必要时,由文件管理部门组织会审,主要对文件的适宜性、充分性以及内容的合法性、操作性和规范性进行审核。经过审核的文件,由质量部门按照《文件控制程序》的要求进行统一分类和编码。
5.1.3文件批准
生产管理负责人和质量管理负责人要通过签名对原版空白批生产记录进行审核并批准。
5.1.4文件发放
文件生效后,所有文件由文控中心按分发部门的需求份数进行复制,并控制文件的复制份数。原版文件或电子版本由文控中心归档保存;发放文件时需建立发放记录,以便在更新版本时收缴旧版本,发放新版本。
5.1.5文件学习
相关部门负责人收到发放的文件后,要及时对本部门相关人员进行培训。只有经过培训且评价合格的人员才能上岗,以此保证有关人员能正确理解文件内容并正确执行。培训时需填写培训记录。
5.1.6文件修订
文件制定后,应根据使用情况或有关要求及时修订,或每年定期进行正常修订。
5.1.7文件回收
文件修订后,由文控中心回收已发放的文件,并填写文件回收记录。同时分发修订后的复制文件,填写文件发放记录。文控中心对于回收的文件,要按照《文件控制程序》的要求保留原版文件;对复印件进行处置,并填写文件处置记录。
5.2记录管理
胶囊用牛骨明胶生产企业制定了《记录控制程序》对记录进行管理。记录管理流程详见图 2。

图 2 记录管理流程图
5.2.1记录填写
记录填写应规范、完整;记录修改也应规范。
5.2.2记录审核
记录审核人员应按照既定频率进行审核;审核人员需履行审核职责,仔细审核记录并签名。
如果记录审核人员无法履职,应书面授权具备相关能力的人员对记录进行审核并且签名。
5.2.3记录批准
记录批准人员应按照既定频率进行批准;批准人员需履行批准职责并签名。
如果记录批准人员无法履职,应书面授权具备相关能力的人员对记录进行批准并签名。
5.2.4记录贮存
以下为记录贮存所涉及的方面:
● 标识:可采用颜色、编号等方式,确保记录易于识别;
● 贮存:记录可通过合适的载体保存,如使用纸张、磁盘、光盘或其他电子媒体。需安排适宜的贮存环境,以防质量记录损坏或丢失;
● 保护:包括对记录的防护和保管要求,目的在于保持记录完好无损。对于存储在电子媒体中的质量记录,需留意电子图像的退化速率;
● 检索:包括对收集、编目、归档、查阅的要求,以达成快速查找的目的;
● 保存期限:通过稳定性试验确定胶囊用牛骨明胶保质期为3年[14]。因此,确定胶囊用牛骨明胶生产记录保存期限为 5 年 [15] ;
5.2.5记录处置
对超过保存期限的记录,应定期清理、统一销毁,并填写记录销毁记录。
Part6 结论
胶囊用牛骨明胶生产企业的记录管理是保障药品质量、符合法规要求和实现可持续发展的关键环节。企业应充分认识其重要性,针对现存问题采取有效改进措施,不断优化记录管理体系,以提高胶囊用牛骨明胶生产的质量和安全性,为公众健康保驾护航。
参考文献
[1] 陈世鹏,陈世会 . 胶囊用牛骨明胶疯牛病的控制 [J]. 明胶科学与技术,2022,42(2):98-103.
[2] 国家药品监督管理局 . 药品生产质 量 管 理 规 范(2010 年修订)[EB/OL].(2011-01-17). https://www.GB/T 19000-2016/ISO 9000:2015[S].北京:中国标准出版社,2016.
[3] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会 . 质量管理体系 基础和术语:GB/T 19000-2016/ISO 9000:2015[S].北京:中国标准出版社,2016.
[4] 曹元,梁毅 . 制药企业批生产记录中存在的问题与分析[J].中国药业,2009,18(02):7-8.
[5] 全国人民代表大会常务委员会 . 中华人民共和国药品管理法(2019年 修 订)[EB/OL].(2019-08-27). https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20190827083801685.html.
[6] 国家药品监督管理局综合司 . 中华人民共和国药品管理法实施条 例( 修 订 草 案 征 求 意 见 稿)[EB/OL]. (2022-05-09). https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20220509222233134.html.
[7] 国家药品监督管理局 . 中 华人民共和国药物警戒质量管理规范 [EB/OL].(2021-05-13). https://www.nmpa.gov.cn/yaopin/ypggtg/20210513151827179.html.[8] 国家市场监督管理总局 . 药品生产监督管理办法 [EB/OL].(2020-01-20). https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/fgs/art/2023/art_65070d0ee03a4109ac831ee7b3cee51c.html.
[9] 国家药品监督管理局 . 药品记录 与 数 据 管 理 要 求( 试 行)[EB/OL].(2020-07-01). https://www.nmpa.gov.cn/xxgk/fgwj/xzhgfxwj/20200701110301645.html.[10] 国家药品监督管理局综合司 . 药用辅料生产质量管理规范(征求意见稿 )[EB/OL].(2024-07-18). https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20240718164243192.html.[11] 国际药用辅料联盟(IPEC), 药品质量小组 (PQG). IPEC-PQG 药用辅料生产质量管理规范指南(2017版) [EB/OL]. http://www.ipec-china.org/info/cn/ipec-china-news/rules/View.aspx?nid=8965.
[12] 杨明臣,尚海宾 . GMP 文件编写的要求[J].机电信息,2014(14):1-316.
[13] 胡晓彤 . 保健食品生产企业批生产记录通用管理规范 [S/OL]. 山东:山东省食品药品审评认证中心,2020-08-26.
[14] 陈世鹏,陈世会,董炎超 . 胶囊用明胶稳定性试验考察 [J]. 流程工业,2023(02):58-61.
[15] 中华人民共和国卫生部 . 食品添加剂明胶生产企业卫生规范:卫监督 发 [2005]535 号 [EB/OL]. (2006-01-23). http://www.nhc.gov.cn/zwgk/wtwj/201304/b467356ea38047bcad275d37ad7c3d80.shtml.
邵丽竹
何发
相关推荐
-
底喷微丸包衣工艺参数对包衣效果的影响分析
流化床底喷微丸包衣的工作原理是借助急速上升的空气流使微丸在包衣室内悬浮流动,微丸在干燥室内上下翻动,利用喷枪借助压缩空气将包衣液雾化喷入流化床,在微丸表面形成一定厚度的膜,同时通入热空气迅速干燥上药后的微丸的包衣方法。
2025-12-04 刘辉宾
-
炒莱菔子配方颗粒提取工艺优化
本研究旨在以炒莱菔子为原料,通过对比动态提取和多功能煎煮提取参数,确定最佳提取工艺,优化炒莱菔子配方颗粒提取工艺,提高产品质量、收率和生产效率。
2025-12-03 李彦飞 史修强 张强
-
特别专题 | 连续制造技术应用现状与挑战
随着连续制造技术在全球制药领域的深入应用,菲特(中国)制药科技有限公司能力中心技术经理朱正辉在接受本刊专访时,从技术优势、行业接受度、实施挑战及 FE CPS 系统创新等维度,深入解析了该技术为固体制剂生产带来的变革与未来前景。
2025-12-03 崔芳菲
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多