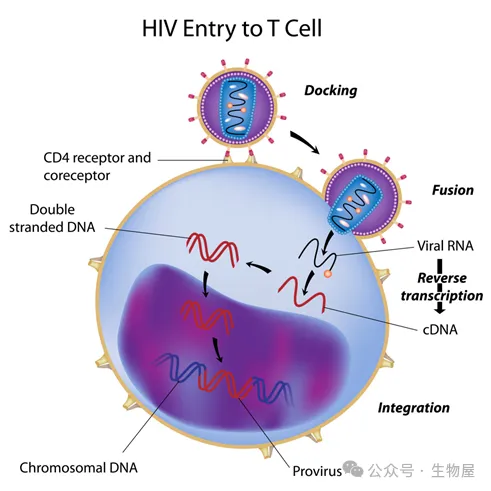
·
1987
年,第一个逆转录酶抑制剂齐多夫定
(azidothymidine
,
Retrovir®
,
AZT®
)
被批准上市,用于
HIV
感染的治疗,
其他的治疗药物也在随后的三十年中陆续被成功研发。
·
随着逆转录酶抑制剂替诺福韦
(Tenofovir
,
Viread®)
和拉米夫定
(Lamivudine
,
Zeffix®)
,以及蛋白酶抑制剂奈非那韦
(Nelfinavir
,
Viracept®)
、利托那韦
(Ritonavir
,
Norvir®)
和茚地那韦
(Indinavir
,
Crixivan®)
等抗
HIV
药物的成功研发,艾滋病的治疗也有了更多的选择
(
图
1)
。
·
在
20
世纪
90
年代后期,开发出了一种更为有效的艾滋病治疗方法,即多药鸡尾酒疗法,也称为高效抗逆转录病毒治疗
(highly active anti-retroviral therapy
,
HAART)
,研发了如
Complera®
和
Stribild®
等
“
单一片剂
”(all-in-one)
复方药物
。
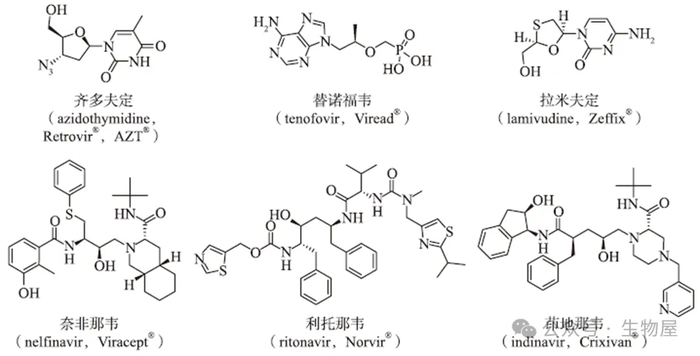
图1 逆转录酶是第一个成功的抗HIV靶点,其相关抑制剂主要包括齐多夫定、替诺福韦和拉米夫定。HIV蛋白酶是另外一个研究较为深入的抗HIV靶点,其代表性抑制剂主要包括奈非那韦、利托那韦和茚地那韦。
毫无疑问,发现新的治疗药物对社会产生了积极的影响,但完全实现这一目标并非易事。从表面上看,针对某一疾病,确定其发病机制,并设计一种能够缓解或治愈这一疾病的药物是一项相对简单的任务。特别是对于感染性疾病,无论是细菌还是病毒,只要消除病原微生物,就可以解决这一问题。当然,这只是一种乐观甚至一厢情愿的想法,因为除了杀灭引发感染的病原微生物之外还有诸多需要关注的因素。虽然可以找到能够杀灭病原微生物的数百万种化合物,但这些化合物中有多少可以达到不对宿主本身产生毒副作用的疗效?其余的化合物中又有多少可以最终成为安全有效的治疗药物?在这些无限的可能性中,该如何确定哪些化合物是有前景的,哪些是没有希望的?在有希望的化合物中,又有哪些能够得到医药企业的青睐?这些问题非常复杂,而对于其他疾病引起的健康问题,相关问题甚至会变得更加错综复杂。例如,对于控制和缓解疼痛的药物,应该在有效缓解慢性疼痛的同时不干扰与人体保护性本能相关的疼痛,如在用药后我们仍然可以在手与热炉接触时能因为感到疼痛而将手快速移开。诸如此类的复杂性问题是绝大多数疾病的共同特征,必须有效地解决才能成功地开发新药。
鉴于药物设计和开发的相关问题繁多复杂,我们应该非常清楚地认识到,没有任何一个人可以独立完成包括药物发现、开发和成功推向市场的所有任务。新药研发的过程是多方面的,因此需要具有广泛专业知识的科研人员共同参与和通力合作,如需要药物化学、生物学、药物代谢、动物药理学、药剂学、过程化学、临床医学和知识产权等领域的专业人才,高通量筛选、分子建模、药物分析和生物标志物研究等技术也在现代药物研究中发挥了至关重要的作用。新药的成功开发需要有兴趣从事药物研发的人员,无论是任职于工业界还是学术机构,都必须有志愿在相当长的一段时间内共同参与和通力协作,以完成相关研究工作。
药物成功研发的回报也是非常诱人的,例如阿托伐他汀
(atorvastatin
,
Lipitor®)
的年销售额超过
130
亿美元,氟西汀
(fluoxetine
,
Prozac®)
的年销售额最高达到
28
亿美元
(
图
2)
,而孟鲁司特
(montelukast
,
Singulair®)2011
年的销售额达
55
亿美元。
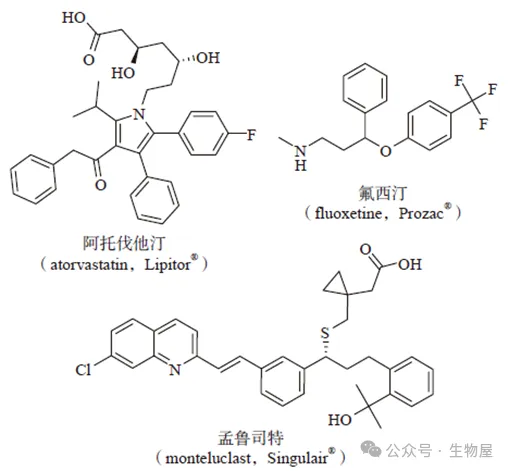
图2 阿托伐他汀、氟西汀和孟鲁司特是制药行业历史上最成功的几个药物。
在面对超高回报的同时,新药研发所需的时间和资源成本同样是巨大的。如图
3
所示,据估计,在
100000
余个化合物中才有可能发现一个成功的药物
,期间需要进行数百项临床前动物研究并开展涉及数千名患者的大量临床试验
。最近对临床试验成功率的分析表明,每
10
个临床候选药物中大概只有
1
个能够成功地通过临床试验并被批准上市
。纵观整个研发过程,如果根据所筛选的化合物数量来看,新药开发的成功率小于
0.001%
。如果依据企业新药开发的立项计划数目来衡量,大概每
24
个研究项目中仅有
1
个能获得成功
。
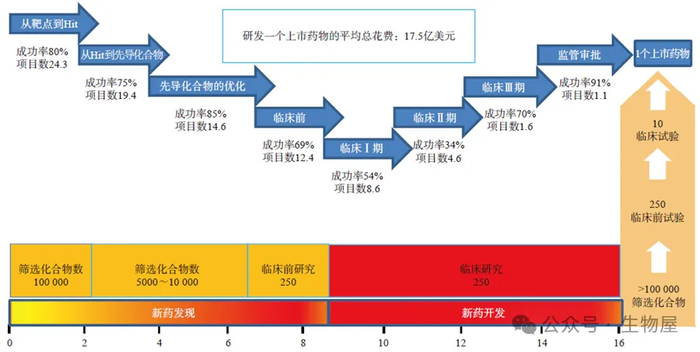
图3 药物发现和开发过程中各个阶段的成功率分析。
除了成功率低之外,成功研发出上市药物的资金投入也是十分惊人的。截至
2011
年,研发一个药物的预估成本超过
17.5
亿美元。
作一个形象的比喻,研发一个药物的资金投入可以购买
17
架波音
737
客机
(
基于
2012
年波音公司网站的价格
)
,也可以购买大约
7000
栋别墅
(
假设每栋价格为
25
万美元
)
,或购买
70000
辆汽车
(
每辆的平均价格为
2.5
万美元
)
,这些资金甚至可将
7000
名
2010
年出生的儿童养育至
18
岁。由此可见,新药研发的费用和复杂程度实在令人咋舌。
药物研发过程可分为两个主要阶段,即药物的发现和药物的开发
(
图
4)
。
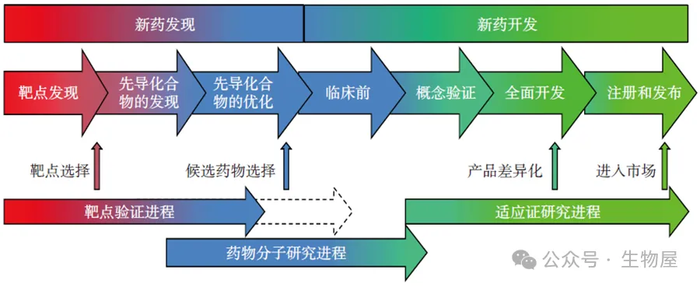
图4 药物发现与开发全过程
·
第一个阶段是药物的发现,包括从最初的靶点识别到确定单一临床候选药物的全过程。药物发现又包括三个步骤,分别是疾病相关治疗靶点的确认、先导化合物的发现及先导化合物的优化。
药物发现过程的每个阶段旨在建立相关靶点
(
如酶、
G
蛋白偶联受体、离子通道等
)
与疾病实验模型之间的科学联系,该过程通常涉及靶点的发现和靶标的验证,主要通过设计合理的分子探针来测试多个系列化合物对靶标生物活性的调节作用来实现。在许多情况下,常采用已知化合物来实现对靶点的选择,并且最终通过先导化合物的发现与优化来获得全新的候选化合物。具体而言,是通过对大量化合物进行系统的生物活性筛选,获得具有预期活性的先导化合物。随后继续开展先导化合物的结构改造和优化,通过反复的活性筛选和再优化,最终获得候选药物,进入药物的开发阶段。通常,先导化合物的发现和优化过程往往重叠在一起,需要对多个系列的化合物同时进行多轮的筛选、优化、再筛选和再优化。这种方法是成功所必需的,因为通常很难确定在一个单一系列的众多化合物中是否包含最终的候选药物。因此,平行操作在一定程度上降低了失败的风险。药物发现阶段所要达成的目的就是发现一个在体内动物模型中有效的化合物,并且具有临床研究所必需的良好理化性质。
·
第二个主要阶段即药物的开发,通常是在确定了一个候选化合物后,通过开展各项实验研究,最终在监管部门的批准下成功上市销售的过程
。该过程的第一步是提交新药研究
(investigational new drug
,
IND)
申请,需要得到批准才能将临床候选药物推进到人体临床试验
。申请文件需向监管机构提供详细的临床前研究数据,详细介绍动物药效学和毒理学研究结果,以及化学生产工艺信息
(
包括剂型、稳定性研究和质量控制方法等
)
。当然如果研究得到批准,还需要提供开展临床研究的详细方案。
虽然每个候选药物的临床试验设计可能不尽相同,但是临床
Ⅰ
期、
Ⅱ
期、
Ⅲ
期和
Ⅳ
期研究的总体目标是相同的
。
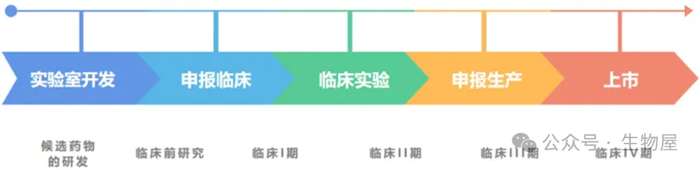
·
临床
Ⅰ
期试验
主要研究新药的安全性和耐受性
,目的是确定其安全范围是否适合开展后期的临床试验,一般在少数健康个体
(
通常为
20-100
人
)
中进行测试,试验中将密切监测候选药物的药代动力学和药效学方面的性质
。首先进行单次递增剂量
(single ascending dose
,
SAD)
研究,然后开展多次递增剂量
(multiple ascending dose
,
MAD)
研究。在
SAD
研究中,先对第一组受试者以某一剂量给药一次,并监测确定药物的影响。如果没有副作用,则提高给药剂量对第二组受试者给药一次,并进行如前所述的监测。以此类推,直至受试者出现不可耐受的副作用,并确定候选药物的最大耐受剂量
(maximum tolerated dose
,
MTD)
。
MAD
研究与
SAD
研究相似,但是会降低每组受试者在一段时间内的给药剂量,并且是多次给药。与
SAD
研究一样,通过监控副作用的出现来测试候选药物的
MTD
。
临床
Ⅰ
期的研究数据将决定后期临床
Ⅱ
期、
Ⅲ
期和
Ⅳ
期的给药剂量。
·
临床
Ⅱ
期试验
一般需要
100-300
名
受试者,主要是测试候选药物是否具有预期的药效
。同样,安全性研究也将贯穿
Ⅱ
期试验的始终。临床
Ⅱ
期试验一般分为两个部分,即
ⅡA
期和
ⅡB
期
。
ⅡA
期的主要目标是确定候选药物发挥疗效所需的剂量
。一旦确定了适当的剂量水平,就可以启动
ⅡB
期研究。
ⅡB
期研究的目标是确定候选药物在有限的受试者群体中的总体药效
。由于存在安全性问题或缺乏药效,大多数临床候选药物在
Ⅱ
期试验中以失败告终。截至
2011
年,只有
34%
的
Ⅱ
期临床候选药物能够成功进入到临床
Ⅲ
期研究。
·
临床
Ⅲ
期试验
将进一步测试候选药物在更大患者群体中的药效
。
Ⅲ
期试验通常是随机的,并在多个临床试验点开展,受试患者人数一般为数百至数千名
。
Ⅲ
期临床研究所需的成本和时间可能会因实验药物的不同而存在很大差异,具体取决于试验的临床终点。通常,用于治疗急性疾病的试验药物
(
如抗感染药物
)
要比治疗慢性病的药物
(
如抗关节炎药物
)
试验周期短、受试患者人数少
。试验中还会密切监测患者的不良反应和副作用,因为较大数量的受试患者更有助于发现只涉及较少受试患者的
Ⅱ
期临床试验中不明显的安全性问题。
Ⅲ
期临床试验
(
特别是慢性疾病
)
中的受试者数量、时间要求和复杂设计都决定了它是药物研发过程中最昂贵的环节
。完成
Ⅲ
期试验后,便可向相应的监管机构提交新药申请。申请文件通常包括候选药物动物试验和人体试验的所有结果、所有安全性问题
(
不良反应和副作用
)
、生产工艺
(
包括确保药物质量的分析方法
)
、所有剂量研究的剂型及详细配方信息,以及药物储藏条件等。
监管审查可能会要求补件,提交其他必要的信息,甚至是增加额外的临床试验来进一步确定候选药物的安全性或有效性。在理想情况下,监管部门会批准申请及有关药物的标签信息,最终新药成功获批上市。
·
新药申请获得监管机构批准并不代表临床试验的结束,一些长期用药的毒副作用可能在
Ⅲ
期临床试验中仍不易被发现
。在许多情况下,监管机构要求开展进一步的跟踪研究,这通常被称为临床
Ⅳ
期试验
或上市后监测
。一般来说,这些研究旨在发现可能存在的罕见不良反应。临床
Ⅳ
期试验监控的患者样本数量要比前期的试验大得多
。基于临床
Ⅳ
期试验的安全性,药品的说明书可能会做出相应的调整,并说明与其他药物联合应用的禁忌,如果发现了非常严重的安全性问题,甚至有撤市的风险。应该指出的是,安全性研究并不是临床
Ⅳ
期试验的唯一目的。制药企业通常可以借助上市后的监督和其他临床研究数据来确定其产品的竞争优势、市场形势和新适应证
。由于这种竞争性的临床试验结果通常难以预测,因此相关试验存在一定程度的风险。在某些情况下,公司雄心勃勃地期望证明他们的候选药物优于竞争对手的药物,但结果却事与愿违。
1.
《药物研发基本原理》第
2
版,〔美〕本杰明·
E.
布拉斯,科学出版社
2. The Drug Development Process. John Wiley & Sons Ltd, 2013.




















评论
加载更多