梳理近10年FDA审计的483表格,各类别审计发现项占比如表 1 所示,厂房、设施和设备的合并占比基本在 20%以上,属于占比最大的类别。厂房、设施和设备是审计人员的关注重点之一,也是发生缺陷较多的领域之一。
表 1 近 10 年 FDA 发布的 483 缺陷项统计
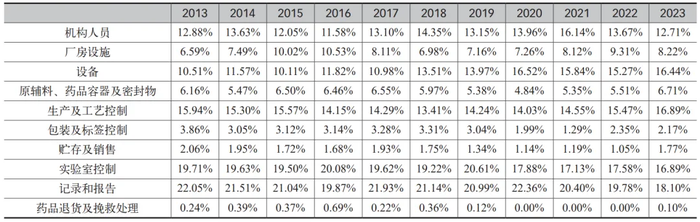
(来源 :FDA 在 2023 财年发布的 483 缺陷项统计梳理)
工程部(有些公司称设备工程部)作为制药工厂厂房、设施和设备的管理部门,值得投入精力去研究并减少缺陷,有效的审计准备可以预防一些不必要的审计发现,同时也是提升自我管理的有效措施。工程部的 GMP 审计准备可以从工程、质量和其他措施这三个方面进行,如图 1 所示。

图 1 工程部 GMP 审计准备的 3 个方面
首先是从工程的角度来准备,主要包括 3 个方面:现场、图纸、运维。
从现场方面来看,厂房、设施和设备都在现场,一般在开完首次会议后,GMP 审计官就会第一时间去现场检查,后续在检查过程中也会不定时地去现场检查。所以现场管理得如何,既是给GMP 审计官的第一印象,也是非常直观的印象。这个印象会直接影响审计官的直接和整体评价。现场准备的要点如下:
● 现场 5S :现场的环境卫生必须做到清洁到位且有记录,特别是设备表面的清洁;管路和设备无跑冒滴漏和锈迹;现场的工具(如有)摆放整齐;现场无异常噪音。
● 厂房:特别是洁净区的厂房,需确保完整性、无划痕(如有,及时处理)、无清洁死角、洁净区缝隙不能有清洁死角,不能有密封胶脱落和缺失、穿墙管线是否有套管、虫害设施是否就位并按SOP 规定进行检查和更换。
● 标识标牌:管路标签、设备标识、部件标牌、房间标识、状态标识等均应完好,并与图纸一致。
● 现场记录:抄表记录、维护记录、消毒记录、清洁记录等
必须满足 GDP要求,并与 SOP 要求一致。
● 校验标签:仪表编号、校验日期、到期日、校验人等信息必须完整、清晰。校验标签必须在显眼位置,并且不能遮挡仪表读数。
● 运行数据:尽量确保 GMP 审计官到现场时,所有设备的数据运行正常、无报警。如果出现异常,必须严格按 SOP 要求,正确且合规地反应,并做必要的记录。
● 设备:洁净公用工程(CU)的连接方式是否是卫生型的、是否存在螺纹连接、是否有不合规的死角(Deadleg)、排水是否有空气隔断、用水点软管使用完后是否拆除并悬挂。
图纸是反映厂房、设施和设备设计的核心文件,也是审计的重要文件。GMP 审计要准备的图纸一般包括厂房的图纸、暖通的图纸、洁净公用工程(CU)和环境监控系统(EMS)的图纸。
● 厂房图纸一般需要准备:厂房平面图:总图、分图;洁净分区图;各种流图:人流、物流、污物流、器具流;设备平面图;车间功能分区图;生物安全等级分区图(如有);门禁互锁图;虫害控制图等。
● 暖通图纸一般需要准备:压差平面图;空调分区图;空调流程图:送风、回风、排风图;空调设备布置图;风量平衡表等。
● 洁净公用工程(CU)主要是准备 P&ID 图,包括制备和分配系统,特别要关注取样点和使用点的配置。
● 环境监控系统(EMS)主要是准备监控点位图,以便审计官能够理解重要的GMP 区域和设备是否有在线监控。
图纸准备不是目的,而是在准备这些图纸的过程中,审核图纸信息的准确性、合规性,这才是要点。譬如准备压缩空气系统的图纸,对于无菌制剂,终端过滤器是否在图纸上有体现,这会是审计的关注点。
运维是厂房、设施、设备的运行和维护管理,主要从四个方面准备:SOP、记录、维护、维修。
● SOP :SOP 是运维管理的基础和指导,SOP的起草必须结合设备的特性、验证的结论、法规的要求,形成自己公司的特有管理规程。图 2 中的内容可以作为参考。同时 SOP 必须易懂、易执行、各项要求有对应的记录支持执行情况。
 图 2 运维 SOP 的内容
● 记录:一般厂房、设施和设备的记录有点检或巡检记录、维护记录、维修记录、消毒记录、清洁记录等。准备的要点是确认记录与对应 SOP 的要求是否一致(譬如巡检记录,SOP 要求每班巡检,执行时变成了每天巡检了)?记录的详细程度是否足够(譬如纯化水的定期消毒,是否记录了开始时间、达到消毒温度的时间、消毒结束时间,维持消毒温度的时间是否满足 SOP 要求)?记录是否符合 GDP 的要求(譬如是否随意涂改,审核签字是否及时)?记录中的异常处理是否有对应的记录?与其他记录的链接(如巡检或维护时有异常,更换了某一部件,这个更换部件是有另外的维修工单,在本记录中是否说明了要参见另外的维修工单)?现场的记录是否及时归档?
● 维护与维修:首先,维护记录的格式设计,是否记录了实际的维护结果,不建议采用打钩的方式,一般维护记录应该包括维护内容、频率、标准、结果记录、审核人等信息;其次,维护与法规的匹配性,譬如过滤器完整性测试是否满足法规要求;再次,维修后恢复使用,是否经过必要的清洁、测试和验证,相应的记录是否齐全?最后,就是部件的非同等(Like for Like)更换是否走变更流程?
就质量方面来说,准备工作同样需要关注 3 个方面:调试与确认(C&Q)、偏差、变更。对于 GMP 审计准备来说,重点是本审计周期内的关键设备和新设备。
● 确认初始验证是否充分?包括验证文件是否充分(是否有缺失)?验证内容是否充分(是否完整、详细)?
● 确认定期再验证是否按计划完成?并符合法规要求?
● 确认验证过程中的偏差是否处理合适?并有相应的记录支持?
● 验证文件中是否有小错误,相应的附件和附录是否完整?
● 确认验证结论是否移植到对应的运维 SOP 中?实际的运维是否按验证结论执行?
● 温度分布测试:必要的测试是否进行了?是否区分夏冬季?是否进行了必要的温度分布再测试(Remapping)?
调试与确认是个系统化的工作,是GMP 审计的重点关注之一,如下 3 点必须引起重视:
● 基本上所有的设备都带有自动化甚至部分计算机化系统,自动化和计算机化系统的验证如何体现?是否有遗漏?
● 系统释放使用的说明是否充分?特别是在调试和确认中,一般或多或少会出现一些偏差,此时,释放使用的文字描述要非常慎重,是直接释放使用、有条件释放使用还是暂缓释放使用,必须阐述清楚,避免遗患。
● 本周期内的关键偏差,需提前预演,明确审计是由谁去和审计官解释?怎么解释?准备哪些材料?
● 对于重复偏差,尤其要准备,阐明调查的根本原因和制定的整改行动是有效的。
● 对于偏差未关闭而继续生产,必须把当时继续生产的说明文件找出来,重新审查,准备好如何向审计官解释。
图 2 运维 SOP 的内容
● 记录:一般厂房、设施和设备的记录有点检或巡检记录、维护记录、维修记录、消毒记录、清洁记录等。准备的要点是确认记录与对应 SOP 的要求是否一致(譬如巡检记录,SOP 要求每班巡检,执行时变成了每天巡检了)?记录的详细程度是否足够(譬如纯化水的定期消毒,是否记录了开始时间、达到消毒温度的时间、消毒结束时间,维持消毒温度的时间是否满足 SOP 要求)?记录是否符合 GDP 的要求(譬如是否随意涂改,审核签字是否及时)?记录中的异常处理是否有对应的记录?与其他记录的链接(如巡检或维护时有异常,更换了某一部件,这个更换部件是有另外的维修工单,在本记录中是否说明了要参见另外的维修工单)?现场的记录是否及时归档?
● 维护与维修:首先,维护记录的格式设计,是否记录了实际的维护结果,不建议采用打钩的方式,一般维护记录应该包括维护内容、频率、标准、结果记录、审核人等信息;其次,维护与法规的匹配性,譬如过滤器完整性测试是否满足法规要求;再次,维修后恢复使用,是否经过必要的清洁、测试和验证,相应的记录是否齐全?最后,就是部件的非同等(Like for Like)更换是否走变更流程?
就质量方面来说,准备工作同样需要关注 3 个方面:调试与确认(C&Q)、偏差、变更。对于 GMP 审计准备来说,重点是本审计周期内的关键设备和新设备。
● 确认初始验证是否充分?包括验证文件是否充分(是否有缺失)?验证内容是否充分(是否完整、详细)?
● 确认定期再验证是否按计划完成?并符合法规要求?
● 确认验证过程中的偏差是否处理合适?并有相应的记录支持?
● 验证文件中是否有小错误,相应的附件和附录是否完整?
● 确认验证结论是否移植到对应的运维 SOP 中?实际的运维是否按验证结论执行?
● 温度分布测试:必要的测试是否进行了?是否区分夏冬季?是否进行了必要的温度分布再测试(Remapping)?
调试与确认是个系统化的工作,是GMP 审计的重点关注之一,如下 3 点必须引起重视:
● 基本上所有的设备都带有自动化甚至部分计算机化系统,自动化和计算机化系统的验证如何体现?是否有遗漏?
● 系统释放使用的说明是否充分?特别是在调试和确认中,一般或多或少会出现一些偏差,此时,释放使用的文字描述要非常慎重,是直接释放使用、有条件释放使用还是暂缓释放使用,必须阐述清楚,避免遗患。
● 本周期内的关键偏差,需提前预演,明确审计是由谁去和审计官解释?怎么解释?准备哪些材料?
● 对于重复偏差,尤其要准备,阐明调查的根本原因和制定的整改行动是有效的。
● 对于偏差未关闭而继续生产,必须把当时继续生产的说明文件找出来,重新审查,准备好如何向审计官解释。
变更需要从如下方面准备:
● 本周期内的关键变更或大型改扩建的变更,需提前预演,明确审计是由谁去和审计官沟通?怎么沟通?准备哪些材料?
● 对于变更而导致的偏差,尤其要重视,必须准备好如何与审计官进行解释沟通。
● 对于变更未审批而继续生产,必须把当时继续生产的说明文件找出来,重新审查,准备好如何向审计官解释。
其他的准备包括新项目、关键文件、4 个要点和持续改进。
本审计周期内的厂房、设施、设备的新建和改扩建项目一般都是审计的重点,特别是比较大的项目。审计的关注点主要是,新项目的变更文件是否充分?新项目的调试和确认是否充分?相应的文件和图纸是否更新并合规?对于复杂的项目,各系统、设备释放使用的先后顺序是否合理,这是非常重要的。
一般制药工厂会有 4 个关键文件可能是审计的关注点,分别是污染控制策略文件(CCS)、共线评估、工厂主文件(SMF)、验证主计划(VMP)。这些文件中涉及到的厂房、设施、设备的描述是否准确?是否是最新的?是否合适?在审计准备时,这些文件必须重新审查。
四个要点是报警管理、备件管理、校验管理、退役管理。
● 报警管理会关注 5 个方面,分别是报警限设定的合理性;报警延时设置的合理性;报警反应流程的合理性;报警记录的合理性;报警与偏差的关系(什么报警通过报警记录就可以了,什么报警必须走偏差流程)。
● 备件管理会关注 4 个方面,分别是洁净区备件的存储和进出管控是否合理;特殊备件的管控(如润滑油和润滑脂、密封胶)是否合理;备件的证书(如材质证明、COA)是否保存;是否有备件缺失的偏差和变更。
● 校验管理会关注 5 个方面,分别是校验仪表清单是否实时和完整;校验仪表的分类是否合理;校验异常或超标时的反应流程和记录是否具备并合理;内部自己校验的仪表是否有对应的校验SOP ;外部校验的,对校验供应商的管理是怎样的。
● 退役管理会关注 4 个方面,分别是最后一次的维护、校验、确认(如需)是否进行了;数据是否存档了;相应的文件和清单是否更新了;除污染(Decontamination)是否进行了(如果需要)。
持续改进是通过审计准备将之前出现的问题和改进在审计时(合适的机会)充分地展示给审计官,提升审计官对厂房、设施和设备管理的信心。持续改进一般包括 3 个方面。分别是根本原因分析(RCA):对于故障维修和偏差的根本原因调查,并制定出有效的纠正和预防措施;差距分析:通过对内外部法规要求、法规变化及时地进行差距分析,并制定出改进措施;风险识别:通过新知识、新认识、新人员对现有的厂房、设施和设备进行持续的风险识别,并制定改进措施。这 3 个方面既是合规的期望,也是持续改进的重要手段。
有效的审计准备可以有的放矢,达到事半功倍的效果。另外有 3份关于审计准备的文件可以参考学习:PIC/S Audit Checklist; PIC/S Aide-Memoire Inspection of Utilities; Guide:GMP Checklist for ATMP Manufacturers(Equipment, Utilities, Premises)。
本文主要讨论了 GMP 审计前的准备,至于 GMP 审计中的准备(如何安排陪同人员,如何回答审计官的提问,如何及时整改等)和审计后的总结与复盘,也很重要,本文不做阐述。
参考文献:
[1] FDA 在 2023 财年发布的 483 缺陷项统计梳理 https://view.inews.qq.com/k/20231130A0AOU500?noredirect=1&web_channel=wap&openApp=false


 图 2 运维 SOP 的内容
图 2 运维 SOP 的内容













评论
加载更多