注射剂生产过程中可见异物产生途径及控制策略
赵杰、刁兴彬、马秀娟、王鑫、曹鸿雁
2024-08-02
目的:分析注射剂中可见异物的产生及控制措施,可见异物的检查方法,以降低注射剂中出现可见异物的风险。
方法:本文结合美国FDA《注射剂可见异物检查行业指南(草案)》和对药品生产企业的检查工作经验,从人、机、料、法、环等各方面,分析查找了注射剂药品生产过程中可见异物的主要产生途径、控制策略及可见异物的检测方法。
结果与结论:注射剂中可见异物是一项重要的质量控制指标,直接关系患者的安全,因此控制注射剂中可见异物尤为重要。
可见异物是指存在于注射剂、滴眼剂中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50 µm[1],国内可见异物类型通常分为外源性物质,如纤维、金属屑、玻璃屑等和内源性物质,如原料相关的不溶物、药物放置后析出的沉淀物等。美国FDA于2021年12月发布了《注射剂可见异物检查行业指南(草案)》[2][Inspectionsof Injectable Products for Visible ParticulatesGuidance for Industry (Drug Guidance),以下简称FDA指南草案],从来源、性质与风险等级等方面将可见异物分为固有颗粒(产品特性所固有的颗粒)、内部颗粒(来自生产设备、产品配方或容器系统的颗粒)和外来颗粒(源自生产环境的颗粒,是生产工艺的外来异物)。
若注射剂中不慎混入可见异物,便会经由静脉注射直接进入人体,造成血管炎、血栓、微血管阻塞等,极大地危害人体健康[3]。对药品生产中的可见异物控制不仅是法规要求,更是药品安全的有力保障,可见异物的控制也成为各注射剂生产企业的难点和要点问题[4]。《中华人民共和国药典》(ChP)[5]规定注射剂不能检出明显可见异物,对于点状物、2 mm以下的短纤维和块状物等微细可见异物也根据不同类型药物和不同给药途径制定了相应的可接受标准。《美国药典》(USP)[6-7]规定注射剂应基本不含可见异物。
根据制药行业内的生产企业的情况、不同的管理水平及硬件设施,每个生产单位的产品中可见异物的数量及分布特点均不相同,但整体上玻璃、纤维、白点、色块占据绝大部分。管理相对完善、硬件设施较好的单位,一般产品的灯检合格率能达96%,甚至98%以上,而一般情况下,灯检合格率不超过90%,个别单位甚至不超过80%。产品中的可见异物不合格,对于患者用药安全有巨大的隐患,同时也对制药行业的发展产生较大负面影响。
本文结合FDA指南草案和国内药企的现状,分析注射剂产品生产过程中可见异物的主要产生途径及控制策略。
FDA指南草案认为内部颗粒可能来自组件、容器、瓶盖(如玻璃瓶、橡胶塞)和产品接触加工设备(如管道、过滤器、垫圈),还与产品配方或其容器密闭系统的稳定性有关。外部颗粒可能是由于制造设施中的恶劣条件(如环境控制不良;设计不良,设备老化及维护不到位;设施位置,施工和维护的不良影响;物料和人员非常规流动),也就是可见异物可从药品生产的各个环节中产生或引入。下面从人、机、料、法、环及工艺等各方面汇总分析注射剂药品生产过程中可见异物的产生途径,见图1。
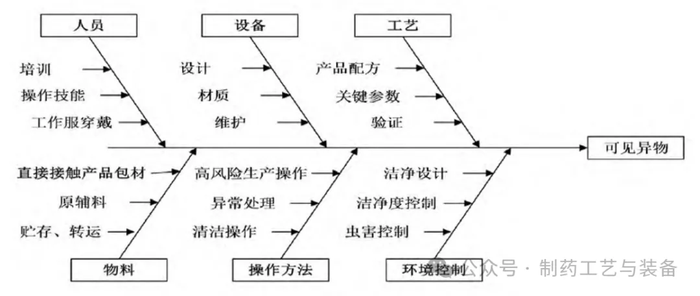
人是最大的污染源,如果人员洁净服穿戴不规范,则可能将身体散发出来的细菌、微粒带入产品中[8]。关键的生产操作和清洁操作若未严格按照标准操作程序(SOP)操作,也会导致药品的异物污染,如污染风险较高的灌装操作时,如果人员操作不规范,在洁净区走动过快或随意开门调整维修,均会干扰生产,产生过多的微粒,导致药品产生可见异物。
一般因人员引入的可见异物种类主要是纤维、白块等可见异物,数量的多少与人员违规操作的频次和幅度有极大关系。此种情况下,可见异物有着时间段区分的特点,也是最容易进行分析与处理的地方。
药品生产中所用的洗瓶机、隧道烘箱、配制过滤系统、灌封机等关键设备的设计合理性、设备材质及与产品的兼容性甚至其维护保养状态均是导致药品异物污染的主要因素。如因安瓿瓶口径较小,在洗瓶过程中,若洗瓶机上喷针位置发生偏差,可戳破瓶口造成玻璃屑进入瓶内;在生产过程中,如果玻璃瓶在隧道烘箱高温段存放超过一定时间,爆瓶风险也随即增加。同时,由于隧道烘箱采用热风循环方式,网带上的玻璃屑难以全部清除,在热风循环过程中玻璃屑会被吹起,掉落至灭菌后的安瓿内,形成二次污染[9]。配制过滤系统与产品直接接触,若其材质与药液相容性差可导致产品产生异物,如某些高浓度盐类产品会对不锈钢产生较大的腐蚀性,导致大量的金属离子进入药液中,药液在存放过程中会产生烟雾状沉淀现象;灌封机是生产过程中异物进入的直接途径,药液灌装的动态过程本身会产生大量尘粒,如机械摩擦、包材摩擦等;A级送风的保护作用是有限的,异物或尘粒数量增加时,进入产品的异物数量将急剧增加。另外,在进行实际生产过程中,经常使用的注射用水和纯化水,在一定条件下,水中的镁、钙、铁离子会形成络合离子,在室温下容易出现白点[10]。
因设备问题引入的可见异物,通常为大小不同玻璃屑,与设备使用情况及维保情况有极大关系。若产品中可见异物检查中发现玻璃屑的占比高,可从设备方面进行分析、处理、改进。
由于产品特性,在生产时工艺控制不当会导致出现可见异物。如生产某些分子量较大的糖苷类、淀粉类输液产品时,灭菌冷却至室温后出现可见异物,随着贮存时间的延长药液中白点、白块逐渐增多,即药液温度较高时不明显,正常灯检条件下不易检出,放置后异物明显增加。连续几天生产含糖产品时,可能会发现药液中白点白块等可见异物逐渐加重现象,且生产设备如配制罐及管线表面会粘附黏膜状物质,如果更换生产品种时清洁不彻底,极易造成下一产品中可见异物如白点、白块数量增加。实践表明,该类产品需要对产品的配制工艺参数,包括活性炭加入顺序、过滤温度、pH值范围等进行仔细考察筛选。
如果更换生产品种时清洁方式规定不合适,极易造成下一产品中可见异物如白点、白块数量增加;需要清洗的包材安瓿瓶,在清洗时,由于喷洗压力不够,附着在瓶内的杂质无法进行冲洗易产生异物[11];直接接触药液的工艺用气如氮气、二氧化碳、压缩空气等过滤、管线清洁等处理不到位导致带入异物。
生产环境是药品污染异物的直接途径之一,控制不良会增加异物进入机率,严重时还会有毛发、昆虫等大型异物进入产品。生产车间布局不合理,墙体材料产生微粒和脱落物,车间空气净化不符合规定,工作人员不按照规定穿戴工作服、帽、手套、口罩,工作服脱落纤维和颗粒,都是可见异物带入药液的原因[12]。生产企业对于厂房设施等没有进行及时的验证或确认,没有对厂房设施进行有效的控制,都会将可见异物带入至产品中来。
可见异物会对整体产品质量产生负面影响。为确保产品质量及减少临床风险,FDA指南草案指出制造商应在产品开发期间进行风险评估,考虑颗粒物的潜在来源、监测颗粒物的适当分析方法,采用不同技术确定可见异物尺寸范围,数量和成分以及每种类型的风险,基于风险评估结果,以及应在严格确保注射剂生产符合《药品生产质量管理规范》(GMP)要求的基础上,建立整体的控制策略。我国无菌药品附录第七十九条:应当逐一对无菌药品的外部污染或其它缺陷进行检查。
人员方面
:部分人员培训不到位,如灌封岗位操作人员从灌封线传送带下经过时,双手接触地面后未对手部进行消毒;《培养基模拟灌装验证方案(试行)》未模拟传送轨道、自动进出料系统操作工位上的干预操作。
设备方面
:如设备维护、保养不及时,最终灭菌生产线稀配罐维护保养不到位,现场检查时稀配岗位工作人员打开稀配罐口时把密封垫带下;企业对进入冻干机的冻干框的管理不足,现场检查时未见操作人员按照要求用注射用水进行清洁,且企业未对冻干板框的清洁效果进行确认。
物料方面
:如大溶液生产车间,软包装的接口组合盖等包材外包装清洁不彻底携带异物进入灌装区,产品组装时进入药液中;胶塞、铝盖等包材生产环境不达标,夹带异物,使用时未有效去除带入异物。
操作方面
:灌封岗位操作及维修人员无菌操作不规范,如上半身进入A级洁净区操作;《灯检岗位标准操作规程》规定灯检时按直、横、倒的顺序检查,现场检查时灯检人员实际按横、倒的顺序进行灯检。
环境方面
:小容量注射剂车间C级洁净区未进行悬浮粒子、浮游菌动态环境监测,亦未制定监测标准和规程;洗烘间内洁净压缩空气管道与顶棚连接处开胶。
根据多年对药品生产企业的检查经验,总结生产过程中可见异物的控制措施,具体见表1。

药品生产过程中可见异物的检查方法主要是灯检法,生产过程中应采用经过验证的方法对注射剂中可见异物进行100%检查并剔除不合格产品,并应在最易检测到可见异物的工序进行检查[13]。目前常用的可见异物检查方法包括人工灯检、半自动化检测和自动检测。
为提供足够的对比度,人工灯检岗位应使用黑色或者白色背景,并根据容器的颜色、尺寸和形状以及产品特性来验证光照强度和检查时间。
人工灯检目前在药厂中应用率较高,但也有诸多缺陷,一是漏检率受人为主观影响较大,其中包括灯检工的经验水平、身体心理状态、视力疲劳程度等;二是供试品溶液或内包材如果带有颜色,影响较显著,如盐酸左氧氟沙星注射液;三是对于各种粒子捕捉、辨别、判定的尺度难于统一规范、传达和表达导致不同的人判定标准不一致。
半自动化检测是将全设备检测与人工灯检结合,在传送带帮助下,容器可在操作工面前以恒定速度上下翻转或旋转,停止后操作工检查可见异物,机械或者手动剔除不合格产品。
半自动化检测设备必须应与其他生产设备一样,定期确认,尤其是传送带速度,并且需要有经过批准的书面程序规定对设备进行日常校准或者检查。
自动化检测一般是采用高速工业相机、可见二极管阵列、X 射线、近场雷达、紫外和近红外光谱的原理区别产品中的可见异物、气泡、透明异物等。与人工检查相比,自动检测技术可以提高可见异物的可检测性,在某些情况下,该技术可检测更高水平的特定可见颗粒,具有更高的统计可靠性。缺点是对硬件要求比较高,需要先进的光学技术和计算机控制系统。目前,大多数企业青睐于自动灯检机的开发使用,但是也要选择合适型号并进行精确调试。如目前市面上水针剂使用的全自动灯检机灵敏度非常高,异物漏检率可达万分之三以下,且设备工作效率高,能大幅降低人工成本。
注射剂药品生产过程中可见异物产生的原因涉及生产的每一细微步骤,不同剂型、不同生产工艺和控制技术异物控制水平差异很大,应具体分析生产过程中的各种因素,采取风险评估的方式确定每一步骤操作要点和监控措施,同时加大原辅材料的质量控制力度,严格规范灯检职工的标准操作方法,才能从根本上减少可见异物污染的发生。
研究可见异物的检查方法不是最终目的,寻找有效的防范措施,从设计、生产到后期把关共同努力才能达到杜绝可见异物的结果。
目前制药行业生产企业的硬件及管理水平参差不齐,各企业需要根据自身的软硬件水平,以及自身产品的可见异物的分布情况进行具体分析,找出能够降低产品的可见异物的方法,不断提高产品的质量。
按照欧盟GMP附录1:无菌药品的生产的要求,质量风险管理的重点应包括对设施、设备和工艺进行适当的设计,然后执行精心设计的程序,最后以检测系统作为要素,证明设计和程序已经得到正确执行。因此,要想加强对注射剂中的可见异物控制,需:
(1)在源头上,在工艺、设备设计中建立“C&Q标准流程”,采用系统的风险评估流程,识别关键方面(CAs)和/或关键设计因素(CDEs),从工艺设备源头设计开始,对可能引入可见异物的因素进行排查,制定系统的控制策略;
(2)可使用AI智能检测系统技术,采用深度学习与人工技能(如智能识别与分类系统),多模态融合(例如复合成像技术、数据融合),自动化与智能化生产线集成(如在线实时监测、预测性维护与质量预警)等。将这些技术结合使用,可构建全方位、多层次的注射剂异物检测体系,提高检测的准确性和效率,确保产品质量符合法规要求;
(3)控制可见异物的产生,是一个持续性的改进过程,需要制药行业对药品生产过程中的缺陷品进行分类,收集并统计各类缺陷品的相关数据,采用季度、年度回顾分析的方法进行持续的监控和改进,才能提高患者用药的安全,保障患者的安全用药。
[1] 宋彦会, 白臣生. 塑料瓶大容量注射剂可见异物来源及控制措施分析[J]. 机电信息, 2018, (2): 54-56.
[2] FDA. Guidance for industry:inspection of injectable products forvisible particulates guidance for industry(draft guidance )[S]. 2021.
[3] 杨桦. 安瓶小容量注射剂可见异物的来源及控制措施[J]. 中国药物经济学, 2016, 11(3): 19-21.
[4] 张连富. 注射剂产品可见异物可控化管理[J]. 上海医药, 2012,(13): 50-54.
[5] 国家药典委员会. 中华人民共和国药典[S]. 2020年版四部. 北京:中国医药科技出版社, 2020: 2-5.
[6] USP. Injections and implanted drug products (parenterals)-productquality Tests<1>[S]. 2022.
[7] USP. Visible particulates in injections<790>[S]. 2022.
[8] 郭倩. 小容量注射剂灯检收率低的原因分析及解决措施[J]. 全科口腔医学电子杂志, 2019, 6(32): 14-16.
[9] 梁凤林. 小容量注射剂可见异物的分析及控制[J]. 机电信息,2018, (17): 32-34, 37.
[10] 汪鹏飞. 有关小容量注射剂可见异物的研究[J]. 求医问药(下半月), 2013, 11(2): 452-453.
[11] 梁忠辉. 安瓿小容量注射剂可见异物来源及控制措施[J]. 临床医药文献电子杂志, 2019, 6(9): 170-172.
[12] 李栋芸. 小容量注射剂可见异物的产生原因及对策[J]. 黑龙江科技信息, 2009, (20): 217.
[13] 李越, 董武军, 张耀, 等. 美国FDA《注射剂可见异物检查行业指南(草案)》介绍与解读[J]. 中国新药杂志, 2023, 32(13):1309-1314.
撰稿人 | 赵杰、刁兴彬、马秀娟、王鑫、曹鸿雁
责任编辑 | 邵丽竹
审核人 | 何发















评论
加载更多