微生物生化鉴定的影响因素探究
微生物鉴定是指借助现有的分类系统,通过对未知微生物的特征测定,对其进行细菌、酵母菌和霉菌大类的区分,或属、种及菌株水平确定的过程,它是药品微生物检验中的重要环节。微生物鉴定的基本程序包括分离纯化和鉴定,鉴定时,一般先将待检菌进行初步的分类。鉴定的方法有表型微生物鉴定和基因型微生物鉴定 [1]。
表型微生物鉴定依据表型特征的表达来区分不同微生物间的差异,是经典的微生物分类鉴定法,以微生物细胞的形态和习性表型为主要指标,通过比较微生物的菌落形态、理化特征和特征化学成分与典型微生物的差异进行鉴别。表型微生物鉴定方法主要有手动生化鉴定方法和自动生化鉴定(采用设备进行鉴定)。手动生化鉴定有 API 鉴定系统、3M 纸片法、选择与鉴定用培养基法等。
基因型微生物鉴定依据核酸测序,比较未知微生物的 DNA 与已知微生物的 DNA 比较,然后与经验证过的专用数据库或利用公共数据库进行比对。
1 材料
本实验主要使用以下鉴定试剂盒、试验微生物和仪器(见表 1,表 2,表 3)。
2 方法与结果
采用梅里埃生化鉴定试剂盒对已知菌进行鉴定,分析并确定鉴定过程中的关键点,完善鉴定的过程。依据API 鉴定的流程,将 API 菌种鉴定方法分为两部分:首先是 API 鉴定盒试剂盒的选择,其次是 API 鉴定。
2.1 生化鉴定
生理生化鉴定是根据微生物对各种生理条件(温度、pH、氧气、渗透压)、生化指标(唯一碳氮源、抗生素、酶等)代谢反应来进行鉴定。API 鉴定是以微生物生化理论为基础,借助微生物信息编码技术的菌种鉴定方法 [2],主要由 API 试剂条、辅助试剂及结果判读系统组成,可鉴定的细菌大于 800种。API 鉴定用于细菌鉴定的有 15 个鉴定系列,分别有对应的菌种数据库[3]。
2.2 API 鉴定试验方法
依据 API 鉴定的流程,将 API 菌种鉴定分为两个步骤 [4],分别是初筛试验(API 鉴定盒试剂盒的选择)和API 鉴定。
2.2.1 初筛试验
初筛试验包括革兰氏染色、接触酶试验、氧化酶试验、OF 培养基、M培养基、凝固酶实验等。初筛试验是最关键的一步,若给出了错误的结果,将影响后续试验,包括微生物鉴定试剂盒和引物等的选用。
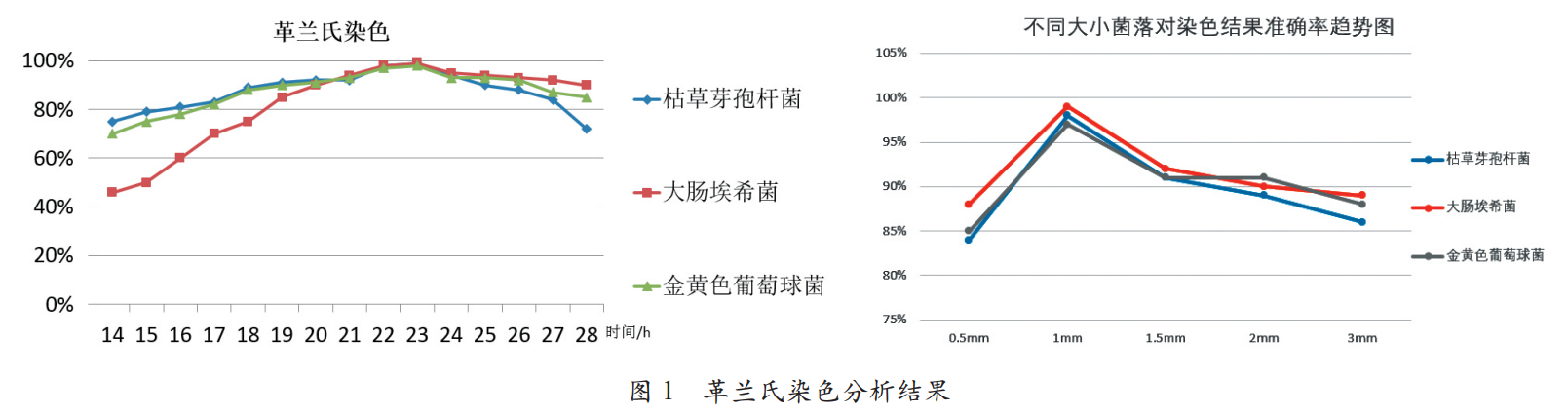
试验分析了枯草芽孢杆菌、大肠埃希菌、金黄色葡萄球菌不同培养时间、不同菌落大小的刮取量染色的情况,得出如下结论:培养时间不足或时间过长会导致部分染色结果介于淡红色和蓝紫色之间,会造成革兰氏染色结果判断不准。
2.2.2 API 鉴定
(1)试条的准备
准备一个培养盒(盘和盖子),倒入约 5 mL 注射用水于盘的蜂窝小凹中,造成一个湿室。记录菌株资料于盘的长边部分(不记在盖上,以免错放)。从包装中取出试条,并放入培养盒中。
(2)接种物的制备
打开安瓿培养基或悬浮液培养基;用吸管,通过吸取或反复涂抹挑取培养 18 ~ 24 h 的新鲜菌落。制成相应浊度的均一菌悬液。菌悬液制备好后应立即使用。或按试剂盒说明书使用。
(3)试条的接种
将菌液按要求添加至生化管杯中,沿杯壁注入,以免产生气泡,小心注入,盖上盖子,在合适温度孵育对应时间。
(4)试条的判读
培养一段时间后,判断每个杯内生长状况比较。通过采用观察角度、观察背景,颜色的判别依据对每个生化反应杯的结果进行识别。同时记录于报告单。为了在继续培养时避免污染,仅在判读结果时打开盒盖,并即刻盖回。
鉴定结果可根据说明书的判读表读出,也可参照生化检索手册或鉴定软件,得到鉴定结果。
2.2.3 试验内容
(1)革兰氏染色试验
试验分析了枯草芽孢杆菌、大肠埃希菌、金黄色葡萄球菌不同培养时间、不同菌落大小的刮取量染色的情况(见图 1)。
(2)颜色识别
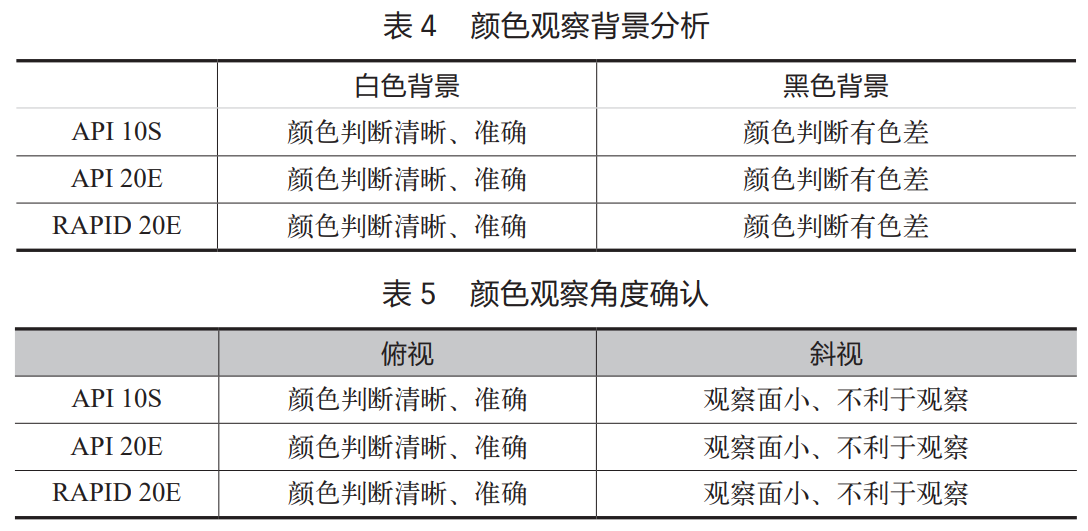
由于鉴定均在洁净区进行,光线仅为日光灯。试验选取无色盲色弱检验员,比较不同观察背景、观察角度,采用标准色卡进行颜色比对,减少主观影响(见表4,表5)。
2.3 试验结果
依据 API 鉴定的流程,初筛试验中分析革兰氏染色结果判断及微生物形态判断,API 鉴定过程中生化管颜色的判断。
2.3.1 革兰氏染色分析结果
试验分析了枯草芽孢杆菌、大肠埃希菌、金黄色葡萄球菌不同培养时间、不同菌落大小的刮取量染色的情况。发现染色时,刮取 1 mm 左右大小的新鲜菌落进行染色可以得到染色结果和细菌形态较为明显。
2.3.2 API 鉴定颜色识别结果
试验选取了无色盲色弱人员进行实验,分析不同观察角度、观察背景、同时分析采用比色卡进行颜色判别准确性的影响。在人员无色盲色弱、白色观察背景时,运用比色卡、垂直观察 API 试剂条检查结果,可得到准确的结果。
(1)颜色观察背景确认
因试验结果在洁净区观察,无自然光,会在日光灯下进行。试验分析白色背景和黑色背景对颜色判断的影响:采用比较了 3 种不同试剂条在白色背景和黑色背景对颜色判断的影响。
试验结果:1、试剂条为白色背景;2、试剂条标识黑色字迹;3、其他颜色背景会对观察结果有干扰。最终确定选用白色背景作为底色。
(2)颜色观察角度确认
因试验结果在洁净区观察,无自然光,会在日光灯下进行。试验分析俯视和斜视对颜色判断的影响:比较了3 种不同试剂条在俯视和斜视对颜色判断的影响。
试验结果:比较俯视和斜视的观察效果,斜视不如俯视便利和对颜色判断的直观。采用俯视对试剂条进行颜色判读。
3 讨论
3.1 鉴定结果分析
根据 API 鉴定法结果分析,初筛试验中革兰氏染色,选择刮取 1 mm 左右大小的新鲜菌落进行染色可以得到染色结果和细菌形态较为明显。因此可以判断其他的染色方法均可进行相同涂片样品制备。
3.2 初筛试验对鉴定结果的影响[5]
初筛试验包括纯化、革兰氏染色、接触酶试验、氧化酶试验、OF 培养基、M 培养基、凝固酶实验等,这些初筛试验决定这些试剂盒的选择,试剂盒检测就是整个鉴定的最后一步。在初筛试验中,首先要保证的是被鉴定菌的纯度,只有被鉴定菌中只有 1 种菌,没有被其他微生物污染,才能保证之后初筛试验的准确性;其次进行初筛试验时,每个操作步骤要清楚,每个试验结果判断的标准不能混淆;最后初筛试验使用的各种试剂均无误,无污染确保结果准确性。必要时可进行重复试验。
3.3 API 鉴定对鉴定结果的影响[6]
API 鉴定时重要的影响因素有菌液的浓度、添加菌液的操作、反应杯结果判断、判读系统的编码计算。菌液的浓度:不同的菌液浓度可能会影响反应杯的变化,导致结果判断错误,因此使用的菌液浓度需通过比浊管或比浊仪进行浓度确认;添加菌液的操作:对于需要密封环境的反应杯,添加菌液时不能产生气泡,其他的也应尽量不产生气泡;反应杯结果判断:反应杯观察主要为颜色的判断,根据这一步受人为的影响较大,通过改善反应杯观察环境,提高颜色判断的准确性;结果判断系统[7]的运用:将每 3 个生化反应分成一组,每组中阳性结果分别标记为1、2、4;将每组数值相加,得到一组编码;数据填入 APIweb中,输出反应的结果。在此过程中应确定每组每个位置对应的反应杯结果对应的标记,同时编码计算时应准确。
参考文献
[1] 中国药典 2020 版第四部 9204 微生物鉴定指导原则
[2] 韩 志 双, 胡 凤 .API 20E 鉴定系统等两种检测方法应用于食品中沙门氏菌的检测结果比较 [J].食 品 安 全 导 刊,2021(13):40-41.DOI:10.16043/j.cnki.cfs.2021.13.018.
[3] 苍金荣,张华,王华 . 梅里埃 API20NE 生化鉴定系统在布鲁氏菌鉴定中的局限性 [J]. 现代检验医学杂志,2016,31(04):157-158.
[4] 王华,苍金荣,归巧娣等 . 梅里埃API20NE,20E 生化鉴定系统在细菌鉴定应用中的局限性 [C]// 中华医学会,中华医学会微生物学与免疫学分会 . 中华医学会 2014 全国微生物学与免疫学学术年会论文汇编 .[ 出版者不详 ],2014:2.
[5] 李文明 . 肠杆菌科细菌生化鉴定系统的研制及评价 [J]. 世界最新医学信息文摘,2017,17(18):253.
[6] 戴小波,曾朱君,许坚锋等 .API与 DL-96 微生物鉴定系统在鉴定室间质控菌株中的对比研究 [J]. 国际检验医学杂志,2013,34(11):1437-1439.
[7] 周 赞 虎, 张 永 祥, 杜 鹃 等 . API20E 对食品中致病微生物检测应用探讨 [C]// 中国林业与环境促进会 . 微生物实用技术生态环境应用学术研讨会论文集 .[ 出版者不详 ],2008:4.
撰稿人 | 姜许帆、陆才洋、蒋芙蓉、申景丰、夏博、刘再德
责任编辑 | 邵丽竹
审核人 | 何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多