美国药品短缺达十年来最高水平,短缺数量多持续时间长
图1 CDER 报告的药品短缺数量,按日期
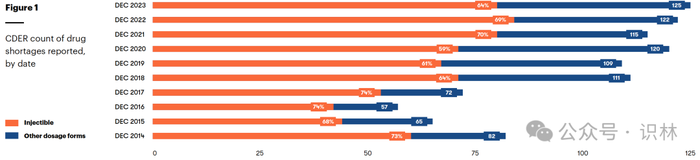
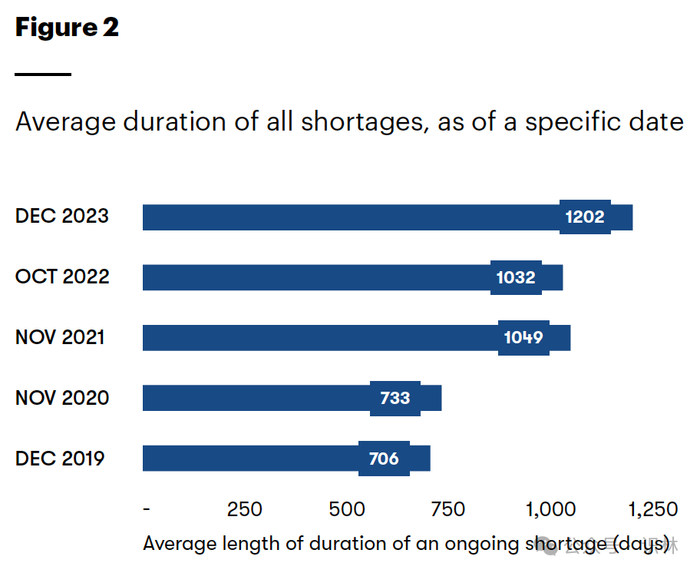
具体来说,2023 年的平均短缺持续时间超过三年(图2),而 2020 年约为两年,125 种短缺药物中有 27 种短缺时间超过五年。53% 的新短缺发生在仿制无菌注射剂中。
图2 截至特定日期的所有短缺的平均持续时间
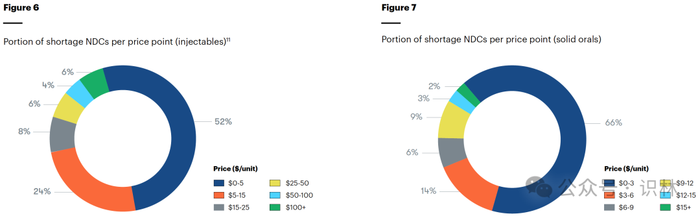
报告中还揭示了一些重要观察:大多数短缺药品的价格不到 5 美元;近三分之一的短缺注射剂价格不到 2 美元;三分之二的短缺口服药价格为 3 美元或更低(见图6、图7)。这些低价也导致更多产品停产,从 2022 年到 2023 年,停产药数量增加了 40%,从 100 种药品增加到 140 种。这也是自 2019 年以来产品停产率最高的一次。
根据报告,药品短缺的罪魁祸首是利润率较低。USP 全球对外事务高级副总裁 Anthony Lakavage 在一份声明中表示,“经济压力,尤其是仿制药商的许多药品价格极低,合同经常被终止,使得仿制药供应链变得非常脆弱。”
这是近期第二份调研药品短缺的报告。上个月,美国卫生系统药剂师协会发现,去年第四季度美国持续和活跃的药品短缺数量为 323 起,这是自 2001 年开始跟踪此类数据以来的最高数字。在 60% 的短缺案例中,短缺原因不明,或者制药商根本没有提供解释。
短缺问题被归咎于多种因素。除了利润低导致制药商放弃市场之外,一些企业的质量控制不佳也日益成为问题。在某些情况下,美国 FDA 会禁止企业分销药品直至场地设施和程序得到纠正和改进。USP 的报告发现,生产短缺药品的场地设施更有可能面临检查问题。报告中指出,“2023 年的数据显示出一种趋势:生产短缺药品的场地设施更有可能获得“官方行动指示”(OAI)检查结果(如图 14 所示)。但根据图 15,这些 OAI 场地设施生产的药品仅占 2023 年短缺药品总产量的 0.8%。在 2023 年,数据表明,生产占短缺药品产量近 40% 的场地设施收到了自愿行动指示(VAI)的检查结果。” USP 指出,虽然检查结果不佳是个警告信号,但并不是导致供应链脆弱性的唯一因素。不过确实提供了有关未来问题潜在位置的警告信号,可以指导缓解药品短缺的工作。
图14 过去5年中短缺和非短缺药品的检查结果对比(截至2023年12月)
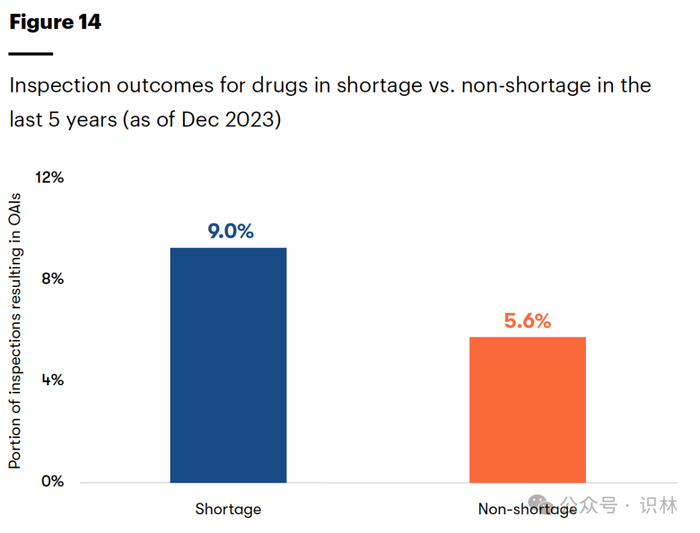
图15 截至2023年12月,短缺药品的生产分布按过去 5 年的检查结果划分

USP 的报告最后总结指出,美国药品短缺主要是由经济因素驱动的,并强调迫切需要找到解决方案来解决这一普遍问题的市场因素。目前仿制药的竞争几乎完全取决于价格,市场既不承认也不奖励药品生产和交付的可靠性和质量。如果市场不根据药品的供应链韧性、可靠性和质量对其进行差别性奖励,即使有资源作为一次性投资用于制药业,短缺情况也可能持续存在。
USP 提出需要进行系统性变革,解决药品短缺的行动应同时满足短期和长期需求,包括风险缓解策略、公共和私人投资与伙伴关系、奖励可靠性和生产质量的支付改革、合作和问责制以及政策改革。一些政策解决方案包括激励高质量和充足的供应链,根据可靠性和弹性区分供应商;投资和建立预警能力以提高供应链的可视性;加强药品地理分布多样化的生产基地;确定有短缺风险的药品并建立脆弱药品清单;协调供应链韧性和可靠性工作。
撰稿人 | 识林-椒
责任编辑 | 邵丽竹
审核人 | 何发
邵丽竹
何发
热点文章
-
几种典型制药工艺流程图分析
2025-10-11
-
阿司匹林合成工艺及装置改进
2025-10-21
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
一文看懂新药研发到上市的全流程
2025-11-25
-
中药颗粒剂生产中的现代化工艺改造
2025-11-04
-
辐照辐照灭菌技术在制药行业中的应用灭菌技术在制药行业中的应用
2025-10-11
-
2025年50家头部药企的竞争格局与核心趋势分析
2025-10-21
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多