制药4.0 mRNA药物连续化生产工艺
一

经过一系列的设计实验,包括建立整个工作流程和方法设计策略,接种、上游生产和质粒扩增,碱性细胞裂解、质粒纯化、DNA线性化,IVT反应器设计与mRNA纯化,mRNA脂质纳米粒(LNP)配方设计,洁净室设计,资源分析方法,总资本投资和生产成本,最低剂量销售价格(MSPD)估算,不确定性分析,可进行以下实验并得出数据:
1. 上游灌注反应器设计
2. 质粒的碱性裂解,纯化和线性化
3. 线性化DNA模板的纯化和IVT
4. LNP配方与自组装
5. 洁净室相关费用
6. 资源投入分析
结 论
通过模型方程,对确定的关键工艺参数进行确定性、多变量、因子敏感性分析,探索操作和材料质量属性的设计空间。上游灌注流量为5 L m2 h−1,孔径为2µm的孔膜,主反应器室容积为1000 L,转速为250 rpm。此外,对于IVT反应器系统,分别以4 mM UTP、10 mM Mg2+和0.5µM聚合酶为输入浓度,研究了3个10 L单位(每个单位的实际工作体积为8 L)。对于色谱块进行的纯化步骤,设备的尺寸分别考虑保留时间为20 min和物料流量为10 L/h,长度为43 cm,直径为21 cm。对mRNA和脂质分子的空间分子排列的初始原子构型进行定向,以保持适当的范德华距离耐受,从而阐明配方物质组成的整体结构。计算了参与典型结构疫苗单元形成的实际分子数,并对模拟过程进行了指导。具有A/B级良好制造认证的洁净室设施被认为与建议的解决方案相匹配。
二
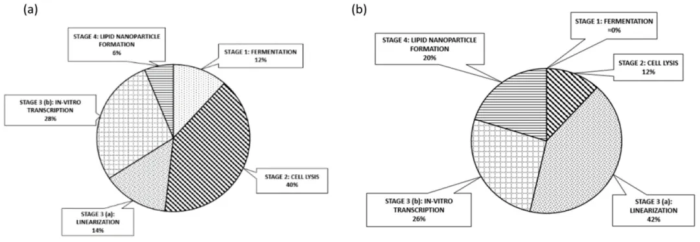
图10.脂质颗粒载体对连续 GMP mRNA 制剂产品总成本(馅饼)的百分比贡献:(a)设备,(b) 原材料;
对于设想的分批到连续的操作转移,一个模拟框架以设计工艺条件是必要的。本文的主要研究发现如下:
一、从细菌培养出发,论证了连续端到端生产的GMP合规性、mRNA LNP配方疫苗技术采用的可行性。为解决这一问题,引入了灌注反应器、SMB色谱步骤、连续细胞裂解模块和微流体配方等创新技术。在严格的质量指令下,这为未来实际的、模块化的过程线开发实施铺平了道路。
二、材料驱动的流程将质量和能量平衡结合或利用文献、经验和实验元素,使我们能够将操作性设计空间框架与关键质量属性联系起来,随后提供了整个过程的全面映射,可用于进一步的实验优化。对于所研究的工艺过程和代表性材料体系,出血率、停留时间和UTP浓度分别被确定为灌注生物反应器和IVT反应器组分块的关键参数。
三、这种数字方法进一步使我们能够安全地评估该项目的经济方面,记录某些显著的发现。与单剂量方案相关的MSPD价格预计最可能在1.30 - 1.45欧元之间。事实上,与批量生产相比,连续生产mRNA疫苗的总成本略微相同,这归因于有限的、应用的放大级。MSPD具有保留离散度的特点,因此波动带来的依赖性有限。最后,细胞裂解装置(包括其相关的纯化模块和线性化酶)上升为主要成本因素,分别占设备和原料的40%和42%。
总 结
在工业4.0的背景下的医药制造行业,我们更加重视的是保障药品生产的质量稳定,减少药物在生产过程中由于人为出现的差错,生产过程可视化,生产全流程可追溯。智能制造和医药工业相结合,可大大的提高药品生产质量的稳定性,对于整个生物制药行业,尤其是mRNA药物生产,规范化、标准化的推行显得尤为重要,由于其原材料及生产过程投入成本较高,我们在放大生产的过程中试错率就要控制在一定的成本范围之内,此时,对于整个生产过程中的物料(原料、辅料以及包装材料)、工艺和设备、厂房设施及生产人员、生产记录完整性方面的要求就比较高,而制药工业4.0就能解决半数问题,从而实现mRNA药物放大生产的连续性和可重复性。
撰稿人 | 迈安纳
责任编辑 | 邵丽竹
审核人 | 何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多