重组蛋白生物工艺的最新进展:大肠杆菌
重组 DNA 技术领域的最新进展为生产可用作治疗药物、疫苗和诊断试剂的重组蛋白铺平了道路。用于这些应用的重组蛋白主要使用原核和真核表达宿主系统(例如哺乳动物细胞、细菌、酵母、昆虫细胞和转基因植物)在实验室规模和大规模环境中生产。高效生物工艺策略的开发对于具有治疗和预防意义的重组蛋白的工业生产至关重要。最近,生物工艺的各个领域都取得了进展,并被用来开发生产重组蛋白的有效方法。其中包括使用高通量设备进行有效的生物工艺优化以及一次性系统、连续上游工艺、连续层析、集成式连续生物工艺、质量源于设计和工艺分析技术,以实现更高产量的优质产品。本文总结了重组蛋白生物工艺的最新进展,包括各种表达系统、生物工艺开发以及重组蛋白的上游和下游工艺。
简介
生物制药是制药行业开发的主要药物。市场需求促进了各种蛋白质表达宿主和生物工艺技术的发展。2014 年至 2018 年中期批准的产品包括 68 种单克隆抗体 (mAb)、23 种激素、16 种凝血因子、9 种酶和 7 种疫苗。重组蛋白生产领域的进步改变了以前的趋势,使产量大大提高,成本大大降低,从而允许工业规模生产此类蛋白质,并为治疗多种疾病打开了大门。借助重组蛋白技术,利用细菌、哺乳动物细胞、酵母、昆虫细胞、转基因植物和转基因动物实现了基于重组蛋白的生物药物的表达。大肠杆菌生长速度快,产品产量高。酵母系统(酿酒酵母和毕赤酵母)提供翻译后修饰 (PTM)。哺乳动物细胞系已用于大多数已批准的重组疗法。过去3-4年,市场上的71种新型生物制药活性成分中有62种是重组蛋白,其中52种(84%)来自哺乳动物细胞,1种来自转基因系统,5种来自大肠杆菌,4种来自酿酒酵母。表 1 列出了一些获批的重组生物药。
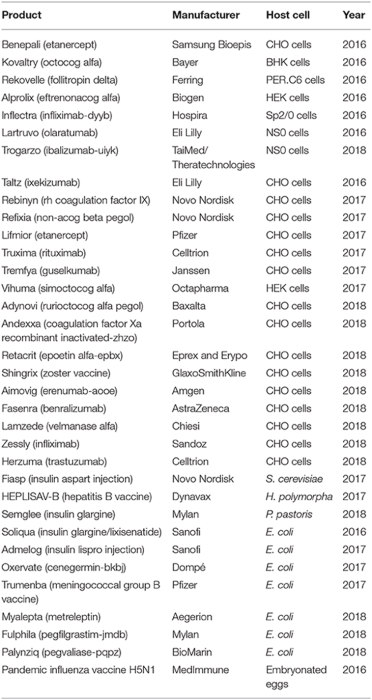
表 1. 部分获批的生物制药及其表达宿主系统和生产商/开发商的离子。
成功的细胞系开发和克隆选择后,使用微量滴定板、试管、组织培养瓶和摇瓶的小规模培养通常用于重组蛋白表达的筛选。各种培养参数,例如培养基成分、pH、搅拌、通气、温度、细胞密度、诱导剂浓度、诱导时间和补料策略,会影响蛋白质表达水平,具体取决于表达系统。因此,有必要评估每种重组蛋白表达的每种培养条件以及有效生物工艺的开发。最近,高通量工艺开发(HTPD)技术已经可用,并以经济有效的方式用于工艺优化。一次性上游和下游工艺技术也已用于重组蛋白,以最大限度地降低生产成本和工艺时间。工艺开发成功后,利用生物反应器系统进行大规模生产,以满足生物制药的需求。批次、补料分批、连续或灌流培养用于重组蛋白的生产。连续生物工艺也已成为一项新技术,并已用于上游和下游工艺开发以及治疗性蛋白质的生产。质量源于设计 (QbD) 和过程分析技术 (PAT) 工具的实施改进了生物制药生产策略。生物过程建模和控制框架还提供了强大的控制解决方案,有利于优化生物工艺设计。最近还开发了集成连续生物工艺;这使得设施和设备占地面积更小,并有利于快速工艺开发和工艺规模放大。生产工艺的新发展在生产成本、生产灵活性以及最终产品质量方面带来了好处。本文将介绍各种宿主系统、生物工艺开发以及用于生产重组蛋白质生物药的生物工艺的最新趋势。
用于重组蛋白生产的表达宿主
重组蛋白可使用多种表达宿主,包括细菌、哺乳动物细胞、酵母、昆虫细胞、转基因动物和转基因植物。高质量重组治疗蛋白的生产对于其在人类中的应用至关重要。蛋白质糖基化是一个重要特征,对重组生物药物的功效、血清半衰期和抗原性起着至关重要的作用。表达宿主系统(例如哺乳动物、酵母和昆虫系统)经过基因工程改造,可在重组产品中产生类似人类的聚糖模式,以避免副作用。最近用于修饰重组蛋白聚糖模式的方法包括选择合适的表达宿主、糖工程和上游工艺优化以控制蛋白糖基化。细胞培养、生化和物理过程参数也与实现重组治疗蛋白所需的糖型有关。因此,在生产此类糖蛋白时需要仔细考虑这些参数。细胞系糖基化模式的重现性对于确保产品质量非常重要。治疗性蛋白质诱导的抗药物抗体可以改变药物药代动力学和药效学,导致疗效受损,有时还会导致严重的安全问题。在最近的一项研究中,治疗性蛋白质免疫原性风险评估被描述为减轻这种风险的一种方法。另一项研究充分描述了使用基因敲除/敲低和过表达来开发有意义的方法,以改善生物药在不同生产平台中的 PTM 及其适用性。代谢工程的最新发展还包括使用基因编辑工具来成功克隆和产品开发。细胞工程的创新,包括使用 RNAi、核酶工程和基于 CRISPR-Cas 的技术,已被应用于寻求更好的抗体生产策略。CRISPR/Cas9、锌指核酸酶 (ZFN)、转录激活子样效应核酸酶 (TALEN) 和重组酶介导的盒式交换 (RMCE) 等基因编辑工具正被用于高效的基因编辑。有文章描述了利用三种主要工具(CRISPR/Cas9、ZFN 和 TALEN)进行基因操作以及相关进展,重点是使用 CRISPR/Cas9 进行“多重基因编辑方法”,对酵母和 CHO 细胞进行基因操作,最终带来一致性的快速产品开发,提高产品产量、质量和可负担性。
大肠杆菌
细菌表达宿主系统(通常是大肠杆菌)是重组蛋白的优选宿主,因为其成本低、众所周知的生物化学和遗传学特性、快速生长和良好的生产力。该系统的一些缺点包括缺乏适当的翻译后修饰 (PTM)、包涵体 (IB) 形成、密码子偏倚和内毒素问题。一些技术,例如在基因序列中添加融合标签、辅因子补充以及蛋白质与分子或化学伴侣的共表达,可以避免 IB 形成并提高可溶性表达。N 端或 C 端的不同标签(例如 Fh8、SUMO、His、TRX 和 MBP)可增强蛋白质溶解度,也有助于亲和纯化。培养后通过降低温度来诱导蛋白质表达,产生可溶性蛋白质。该策略还提高了蛋白质稳定性和正确折叠。此外,新型启动子和糖工程大肠杆菌细胞也导致重组蛋白表达增加。然而,在 IB 中生产重组蛋白具有一些优点,例如宿主细胞蛋白酶对产物的降解率较低。尽管该系统具有多种优点,但缺乏翻译后修饰机制导致纯化过程繁琐。PTM(糖基化、二硫键形成、磷酸化或蛋白水解工艺)参与折叠过程、稳定性和生物活性。已针对 PTM 对大肠杆菌进行了改造,用于生产重组蛋白。大肠杆菌宿主也经过改造可产生糖基化抗体。大肠杆菌经过改造,通过将空肠弯曲杆菌的 N-糖基化系统转移到其中,可以对蛋白质进行简单的糖基化。然而,需要进一步的研究来确定其用于商业治疗性蛋白质的工业生产。具有稀有密码子(例如在人类基因组中发现的密码子)的基因的表达通常会导致低表达并触发蛋白质分子合成的提前终止。稀有密码子的存在可以通过使用密码子优化或宿主修饰来解决。密码子优化可将重组蛋白的表达量提高许多倍。氧化还原环境和折叠酶 [例如二硫键异构酶(Dsb 蛋白)和肽基脯氨酰异构酶 (PPIase)] 对于在周质中形成正确的二硫键是必要的。周质或细胞外空间中蛋白质表达的适当信号序列的结合有助于正确的蛋白质折叠以及最小化的蛋白水解降解。内毒素问题可以通过使用纯化过程来提高细菌衍生治疗药物的安全性来解决。SHuffle 是一种大肠杆菌菌株,被开发用于在其细胞质中正确折叠二硫键蛋白,并成功用于生物活性 IgG 生产。通常用于蛋白质表达的 T7 噬菌体聚合酶也会导致 3-5 个后续代和传代培养后蛋白质表达下降。新型启动子 T7C p/p 系统可以显著提高重组蛋白的产量并促进经济的纯化工艺。有研究使用带有合成操纵基因的 cumate 基因和阻遏蛋白 cymR 开发了一种特定的 pNEW 载体,用于所需基因的组成型表达。与基于 pET 的表达系统相比,该载体导致表达增强。
MoCloFlex是一种用于灵活从头部件/质粒组装的新型模块化克隆系统,据透露,它可用于在24小时内规划、构建和分离定制质粒。这会降低成本和时间消耗。在一项研究中,据报道,大肠杆菌“TatExpress”菌株使用补料分批发酵,通过 Tat 途径将 5.4 g/l 的人类生长激素递送至周质。该蛋白质被证明是均质的、具有二硫键的且具有活性。需要进一步的研究来评估该系统的全部潜力,特别是探索其输出更复杂蛋白质的能力。另一项研究表明,使用不同的碳源和氮源以及乙酸代谢敲除菌株可以将大肠杆菌碳通量重定向到不同的途径,并使蛋白质产量增加 5 倍。
小抗体片段,如单链可变片段 (scFv) 和抗体片段 (Fab),不需要糖基化。因此,这些片段已在大肠杆菌中成功产生。与完整抗体相比,这些抗体片段显示出更好的组织渗透性并且对人体的免疫原性更低。最近,ESETEC分泌技术被开发出来,可以在发酵过程中将重组产物分泌到培养液中,从而获得高产量的Fab(超过4.0g/L)和scFv(高达3.5g/L)。另一项研究表明,抗体片段产生的优化伴随着大肠杆菌周质中应激产生的减轻。因此,应激反应的监测可用于促进重组蛋白产量的提高。膜蛋白在大肠杆菌中的过表达可能会导致毒性和活性蛋白产物的低产量。Snijder 和 Hakulinen描述了与 α-螺旋膜蛋白过表达相关的挑战和克服这些挑战的不同方法,以及使用 His 特异性荧光探针和荧光尺寸排阻色谱表达和筛选膜蛋白的详细方案。另一项研究描述了使用大肠杆菌生产可溶性重组蛋白的策略。
CRISPR/Cas9已被用来成功地将大DNA整合到大肠杆菌中,并且还能够将功能基因整合到不同的大肠杆菌菌株中。在最近的一项研究中,还报道了 CRISPR-Cas9 辅助的天然末端连接编辑为大肠杆菌中的高效基因工程提供了一种简单的策略。另外一篇评论描述了基于 CRISPR 的细菌编辑的现有障碍以及帮助实现和增强细菌编辑的指南。D-丙氨酰-D-丙氨酸羧肽酶基因 dacC 的缺失导致大肠杆菌胞外蛋白产量增强。碱性磷酸酶 (phoA) 启动子和热稳定肠毒素 II (STII) 前导序列也促进了大肠杆菌的胞外生产,用于生产 Fab 片段。已经确定,由于大肠杆菌蛋白质组的有利适应,单链可变抗体片段 (scFv) BL1 的翻译后靶向使其能够在周质中高效生产。研究还表明,通过结合信号肽和生产率筛选,可以在大肠杆菌周质中获得更高的重组蛋白产量。一项研究使用特定的矿物质培养基在大肠杆菌中建立了 I 型分泌系统的规模化,为工业应用铺平了道路。另一项研究讨论了用于提高治疗产品数量和质量的、具有工业化意义的菌株工程策略。此外,有研究描述了使用分层有益调节靶向 (h-BeReTa),采用基因组规模的代谢模型和转录调节网络 (TRN) 来确定菌株改良的相关 TR 目标。翻译异源蛋白质给宿主细胞带来了重大负担,消耗表达资源并导致细胞生长和生产力减慢。在最近的一项研究中,使用基于标准细胞裂解物的分析来量化表达蛋白质编码序列的负担,并提供用于预测大肠杆菌合成基因表达负担的参数。这些裂解物测量结果可与翻译计算模型结合使用,以预测不同功能和长度的多种蛋白质对生长中的大肠杆菌细胞造成的体内负担。尽管在菌株改良方面已经做了很多工作,但仍需要进一步的技术开发。
原文:N.K.Tripathi, A.Shrivastava, Recent Developments in Bioprocessing of Recombinant Proteins: Expression Hosts and Process Development. Front. Bioeng. Biotechnol., 20 December 2019. Sec. Synthetic Biology.
撰稿人 | 生物工艺与技术
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
几种典型制药工艺流程图分析
2025-10-11
-
阿司匹林合成工艺及装置改进
2025-10-21
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
一文看懂新药研发到上市的全流程
2025-11-25
-
中药颗粒剂生产中的现代化工艺改造
2025-11-04
-
辐照辐照灭菌技术在制药行业中的应用灭菌技术在制药行业中的应用
2025-10-11
-
2025年50家头部药企的竞争格局与核心趋势分析
2025-10-21
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多