
细胞和基因疗法(CGT)是利用细胞和基因技术来治疗或预防疾病的新型生物医学手段,被认为是未来医药研发的重要方向之一。随着生命科学的进步和临床需求的增加,近年全球细胞基因疗法研发热度快速提升,诸多创新性产品和技术不断涌现,为治疗癌症、遗传性疾病、罕见病等各类疾病提供了新的治疗途径。
2022年10月31日,国家药品监督管理局食品药品审核查验中心正式发布了《细胞治疗产品生产质量管理指南(试行)》。该指南全文共十三章,涵盖细胞治疗产品《药品生产质量管理规范》(GMP)管理的基本原则、人员、厂房、设施与设备、供者筛查与供者材料、物料与产品、生产管理、质量管理、产品追溯系统等内容。而且该指南提出了关于治疗性起始物料的GMP资质问题,要求直接用于细胞产品生产的基因修饰载体或其他赋予其特定功能的材料(如病毒、质粒、RNA、抗原肽、抗原蛋白、蛋白质RNA复合物等)的生产、检验和放行等过程应符合GMP及其相关附录的要求。但是目前在国内,研究者在不同研发和注册阶段在工艺关键过程中使用病毒、质粒、RNA等上述物料时选择GMP级别物料的途径非常有限,许多研究者并不知道GMP级别物料的意义,造成注册时随意选用关键物料用于临床药品生产,给临床用药乃至市售药品使用带来安全隐患。
假如上述关键活性物料可以按照DMF[1]格式进行物料申报,将推动此类物料的GMP合规水平,研究者基于DMF关联申报可以节省大量工艺研究和设备设施的投入,同时也能给CDE(国家药品监督管理局药品审评中心)这种评审机构节省大量的重复评价时间。
CGT药物研发面临的CMC(化学成分生产和控制)注册挑战,非临床、临床研究法规的出台约束,产品研发注册过程的合规性问题是目前研究过程中普遍存在的问题,CGT治疗产品BLA[2]注册前是设计工艺、验证工艺阶段应该严格遵守注册指导原则要求。
CDE针对目前研究者在临床前研究以及临床研究的药学和质量控制部分出现的主要问题,相继推出很多落地的细胞和基因治疗产品研发注册方面的技术指南。并且,重点针对更细分领域的细胞治疗产品进行了指南的撰写与发布,以指导CGT研究者解决在注册申报过程中遇到的合规性问题;比如CDE最近出台的《人源性干细胞产品药学研究与评价技术指导原则(试行)》、《体外基因修饰系统药学研究与评价技术指导原则(试行)》《体内基因治疗产品药学研究与评价技术指导原则(试行)》、《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》等文件。
为了解决目前基于AAV[3]病毒为基因载体的研究者注册申报存在的大量关键CMC问题,CDE再发CGT指导原则——《腺相关病毒载体类体内基因治疗产品临床试验申请药学研究与评价技术指导原则(征求意见稿)》,这在中国CDE药品注册监管历史上尚属首次。
病毒载体类产品注册关键起始活性物料DMF的CMC属性
以AAV病毒载体类产品为例,AAV药物属于体内基因治疗产品范畴,临床研究的工艺过程质量控制策略依从《体内基因治疗产品药学研究与评价技术指导原则(试行)》所约束的标准。
病毒载体类产品是指通过病毒载体将外源目的基因转移至人体内的基因治疗产品。其中,病毒载体是指经改造用于介导外源基因转移和/或表达的病毒颗粒,常见的有腺相关病毒载体。
体内基因治疗产品类型不同,生产起始原材料或存在一定差异,常见的起始原材料 包括质粒 DNA、细菌种子批、病毒种子批、产毒细胞株/库等。起始原材料应有清晰的来源和完整的溯源信息,一般应按照《中华人民共和国药典》(以下简称《中国药典》)的要求进行建库管理。
起始原材料的质量控制应根据其类型、特性、历史溯源信息、制备过程,以及产品的类型、生产工艺、给药途径等方面的风险确定,质量控制应与其风险相适应。图1展示了AAV基因治疗产品一种常见的工艺设计,AAV基因治疗产品生产用的关键起始物料质粒DNA,目前最常用的设计是三质粒包装系统瞬时转染293细胞用于生产AAV病毒载体,也是最安全的工艺设计。
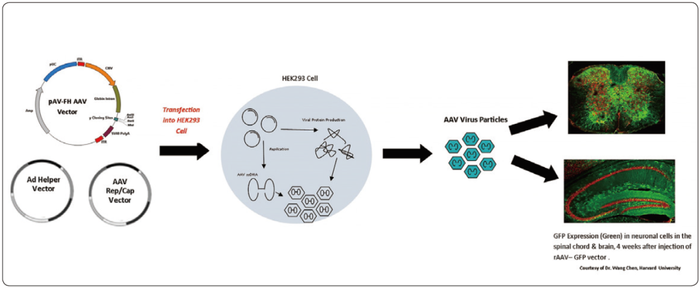
图1 三质粒包装系统瞬时转染293细胞
1.2.2 CGT药物质粒核心物料的GMP要求与DMF属性
起始原材料应有清晰的来源和完整的溯源信息,一般应按照《中国药典》的要求进行建库管理。起始原材料的质量控制应根据其类型、特性、历史溯源信息、制备过程,以及产品的类型、生产工艺、给药途径等方面的风险确定,质量控制应与其风险相适应。
起始原材料质粒 DNA 应基于细菌种子批系统,采用经验证的发酵和纯化工艺制备,质粒生产规模应与后续生产步骤的规模相适应。质粒工艺研发与生产是CGT研究者首先要考量的问题,如图2中标红的辅助质粒可以公共化使用,无需研究者花费大量时间和金钱去研究和建设生产线,既然已经共用化,其DMF属性下的标准就体现出GMP属性。
图2 关键物料质粒的不同应用场景
质粒 DNA 的质量标准一般包括质粒鉴别、含量、纯度、完整质粒或重要基因序列的确认、超螺旋比例、无菌、细菌内毒素、抗生素残留(如适用)、一般理化性质(如 pH 值等)、工艺相关杂质(如宿主菌 DNA残留、宿主菌 RNA 残留、宿主细菌蛋白质残留等)等,具体项目应根据质粒的制备工艺和用途分析确定。每批质粒通过放行检测方能用于产品生产。质粒的贮存稳定性应能支持后续生产步骤的生产。
瞬时转染用于病毒载体包装的质粒,应考虑前述病毒载体设计的一般要求。为了降低病毒生产和使用过程中重组产生可复制型或假野生型病毒的风险,建议优先选择经验证的具有较高安全等级的病毒包装系统,将病毒包装必需元件适当拆分至不同的质粒中,尽量去除非必需的病毒基因,降低质粒之间,质粒与包装细胞及野生病毒序列之间的同源性。例如,AAV 包装系统构建时,将 AAV 的结构基因分离于不同质粒的转录单元中,并尽可能降低 Rep/Cap 基因序列和 ITR等序列之间的相似性等。
直接用于临床的生物分子(如质粒DNA作为DNA疫苗的组分),这类产品的生产必须在GMP环境中,并从GMP生产的种子细胞库(Master Cell Bank,MCB)开始。
对于GMP质粒产品,一个与其他质量要求(尤其是那些非临床研究应用)重要的不同点是生产设备必须是特殊的、专用的、符合GMP规范的区域且配备洁净间。而且,所有的生产流程(如图4所示)都必须是经过验证和授权的,包括获得的结果。
研究者往往需要基于不同质粒进行生产工艺开发,报产注册时将质粒生产工艺申报给CDE,后期辅助质粒DMF化后,研究者只需将穿梭质粒工艺进行申报,辅助质粒以DMF关联评审注册就可以满足申报要求。
具体需要考虑的方面有很多,比如在建库标准工艺与质量表征放行方面,菌种库的质检需符合《中国药典》的要求。
又比如质粒瞬转与稳转系统的区别,多质粒瞬转工艺需要对每个质粒生产建起始原核细菌库,稳转就不需要,所以工艺不同对质粒工艺要求也不同,后期稳转系统对质粒需要进行质量的GMP符合性以及DMF化使用。
再比如质粒的质量放行标准,具备GMP质量属性是质粒后期注册以及形成DMF标准化使用物料的必备条件。
病毒真核包装工艺的设计与注册流程应该符合GMP要求,使用的物料应该具备DMF属性,工艺构成物料应该符合指导原则和法规标准。另外,建立标准工程细胞库并用于注册工艺其细胞培养体系使用的物料也应该符合GMP标准并尽可能DMF化,如图5所示。而病毒纯化工艺可能使用了大量的生物活性物料,所以也应该确认其GMP属性和是否符合DMF注册标准,如图6所示。
图5 标准工程细胞库的建立流程
其他免疫细胞、干细胞类产品注册关键物料的合规性问题
免疫细胞治疗产品、干细胞治疗产品在工艺中使用了大量的细胞因子和生物源物料以及培养体系等关键物料。例如,如图7所示,免疫细胞的扩增激活便使用了大量的细胞因子如IL-2\IL-21细胞因子、修饰细胞用的病毒、生物活性酶等。解决这些物料合规性的最好办法是基于要点要求进行关键物料合规评价。对细胞系、质粒载体、工程细胞系、工艺设计与放大、活性功能性物料、物料及中间产品质量表征研发设计确认、初步稳定性研究、污染控制、研发体系、初步工艺稳定性、动物临床研究用药批次、中试IND注册申报批次、CMC申报体系、人员构成、实验室管理等环节都需要按照指导原则和相应法规进行控制。细胞治疗产品监管政策趋严和降低生产成本的需求正在倒逼研究者对DMF的渴望和需求。
基于复杂的CGT工艺构成与注册,对关键物料实行DMF备案制度可以有效解决目前混乱的注册状态,仅从DMF备案登记范围看,目前美国DMF的适用范围较宽泛,比如Ⅱ类DMF 中除了有原料药外,还包括原料药中间体以及生产过程中使用的物料或制剂。我国的原料药限定在化学原料药,生物制品方面也仅涉及胰岛素类产品。由于我国“DMF”登记范围较窄,国内欠缺一些本来可以通过备案成DMF的GMP级别的标准物料,所以在进行生物活性关键物料控制时,我国研究者需要重复建设大量的生产线以及研发注册。表3展示了现阶段我国与美国DMF备案的异同。
目前国内尚无生物制品DMF登记的平台、通道,国内CGT企业仅可以在国外做DMF登记。
业内已经有众多企业向FDA提交了生物制品用物料的DMF,国内开放DMF登记范围的呼声高涨。
为支持更多CGT研究者把细胞和基因治疗产品创新药“出海”成功,已经有许多研究者、关键物料供应商、CDMO平台公司在提供一系列用于生物药研发、生产的高质量基因编辑蛋白、抗体、细胞因子、关键试剂等领域的关键物料的美国FDA DMF备案服务,研究者在生物药研究项目中需要提交FDA临床申请或上市注册的监管备案文件时可直接引用相关DMF编号,从而节约产品审查和评估时间,缩减新药临床申报的准备工作,这有力促进了研究者的药物上市申报进程。
以宜明细胞的情况为例,目前其已进行了4个方面的FDA DMF备案:
慢病毒辅助质粒系统由分别载有gag-pol基因、Rev基因、VSVG基因的3个辅助质粒构成,VSVG血清型的慢病毒具有广泛的宿主范围,适用于第三代四质粒慢病毒包装系统,能有效降低包装结构的序列同源性及产生有复制能力的病毒(RCL)的可能性,提高安全性。
YM-HELPER2.0质粒是用于腺相关病毒包装的辅助质粒。它提供了一个没有腺病毒(Ad)污染的有效包装系统,携带了生产传染性腺相关病毒(AAV)颗粒所需的腺病毒基因产物,并帮助外源基因片段进入AAV颗粒,从而完成病毒包装过程。
293XS细胞是由宜明细胞自主驯化的悬浮细胞,适用于多种AAV血清型的大规模生产。
此外,在业内也有些公司针对其他领域进行了DMF备案:
生物制品获批IND申报的主要挑战之一便是原辅料的质量控制。IND申报要求需尽可能使用无动物源性的生产原料,以降低引入外源病毒的风险。因此有些公司对一系列无动物源性GMP级细胞因子进行了DMF备案,如 IL-2/IL-7/IL-15已完成美国FDA DMF备案。IL-2/IL-7/IL-15在T细胞增殖、T细胞亚群的生长以及提高CAR-T产品疗效和持久性方面发挥着重要作用。
生物活性酶可高效降解单链、双链、线性、环状、超螺旋等任何形式的DNA及RNA。对其进行FDA的DMF备案,可以满足药物申报的规范。在生物制品的生产工艺中,去除细胞中的杂质是纯化工艺中至关重要的一步。目前已知DNA残留相关的潜在危害包括了免疫原性、感染性(HIV)以及致瘤性(Ras)。从安全和监管两个角度考虑,在生物制品的生产工艺中必须含有去除核酸的步骤,并进行检验验证。为了实现生物制品中DNA残留量的控制,数年来全能核酸酶已被用于相关纯化工艺并取得了良好的效果。
针对目前我国生物制品注册缺少一些关键物料DMF申报路径和监管事项的现状,笔者呼吁放宽国内DMF登记范围,可以先以现在高速发展的CGT行业中需求量最大的质粒登记为开放口,选用国内有代表性的CGT企业或CDMO公司为试点。代表性的CGT企业,尤其是CDMO公司有相对成熟、丰富的CGT产品、物料生产管理经验,应将目前所用辅助质粒提供用于相关注册体系、程序、内容的建立,以确保CGT药品质量,减少药品评审工作量,推动我国CGT产业合规高速发展,同时完善国内DMF管理制度。
[1]DMF,即药物主文件(Drug Master Files,DMF),是DMF持有人递交给NMPA的存档文件,内容包含有用于人用药品再生产、加工、包装和储存过程中用到的生产设施、工艺流程、质量控制及其所用原料、包装材料等详细信息。DMF持有人可授权一个或多个申报人或申办人引用 DMF 中包括的信息,而不需要将这些信息提交给制剂申请人。通常NMPA不会单独审核或批准 DMF 申报,一般仅在审评引用该 DMF的制剂申报时才会关联审核 DMF的技术内容。
[2]BLA,即生物制品上市许可申请(Biologic License Application,BLA),是向美国FDA提交用于支持评审和最终批准生物制品在美国上市和销售的文件材料,在中国这个简称泛指生物制品的药品报产注册申报。
[3]AAV,即腺相关病毒( adeno-associated virus,AAV) ,是一类细小病毒,基因组为单链DNA,对分裂细胞和非分裂细胞均具有感染能力,常作为基因治疗药物的基因载体用于基因药物注册。AAV病毒属细小病毒科依赖病毒属 (dependoparvovius),直径约20 nm、无被膜、是无法自主复制的单链DNA病毒,衣壳由三个AAV结构蛋白组成,共60个单体,呈二十面体对称。AAV基因组大小为4.7 kb,包括末端两个ITR,启动子(P5、p19、p40)、Rep蛋白(Rep78、Rep68、 Rep52和Rep40),VP1、VP2、VP3三种衣壳蛋白比例为1:1:10, 质量分别为 87 kDa、 72 kDa 和 62 kDa,构成这些病毒体的衣壳蛋白的比例的差异,最有可能会影响病毒的感染性,尤其是VP1含量低的情况下。缺乏VP1的病毒体没有感染性,AAP会促进衣壳的组装和成熟。
撰稿人 | 孙秀莲、刘双生、陈瑶、孙艳、吴长访
责任编辑 | 胡静
审核人 | 何发























评论
加载更多