原材料在生物制药生产中的作用:风险分析和指纹识别
简介
生物制药生产,由于其复杂的非线性性质,充满了无数的工艺变化,这些变化可能会影响药物的安全性和有效性。自从二十多年前引入工艺表征和实验设计 (DoE) 等概念以来,生物制药行业在揭示工艺如何影响产品方面已经创造并展示了相当多的专业知识。然而,原材料 (RM) 的作用在某种程度上被忽视了,因此已成为工艺性能和产品质量可变性的主要来源。从ICH Q8指南中可以明显看出,原材料在过程控制策略中的作用越来越重要,该指南建议在“质量源于设计”(QbD)框架中,制造商必须了解包括原材料在内的所有可变性来源。
生物制药生产中使用的原材料来源多种多样,包括用于细胞培养和发酵的培养基成分,用于纯化和化学修饰过程的精细化学品,以及用于最终药品制剂的赋形剂。它们还包括产品接触材料,如一次性塑料袋中使用的塑料。原材料的可变性可能来自于材料的化学或物理特性的变化。这种可变性会影响药品的特性和质量,并可能影响药品的安全性、稳定性和有效性。有时,这会导致严重的不良事件,甚至导致药物召回。例如,在过去几年中,药品中玻璃颗粒的存在导致了20多个产品的召回,包括Procrit和Epogen注射剂的召回。
原材料可变性的类型
原材料的可变性可以细分为三大类。第一类包括通过直接修饰或通过催化修饰 (如过氧化物、醛、还原糖和催化活性金属离子) 改变生物治疗药物质量的微量杂质。第二类由微量杂质组成,这些杂质本身对人体有毒,如铅和铝。第三类包括微生物污染物 (及其相关的内毒素),它们导致原材料的生物负荷发生变化,并可能导致患者产生严重的免疫反应。每一个都需要它们自己的监视和控制方法。
可变性的来源
用于生产重组蛋白的细胞培养工艺使用复杂的生长培养基。虽然一些细胞可以在基础培养基中生产而不需要添加物,但大多数细胞需要添加多达100种成分,如激素、生长因子、维生素、肽、氨基酸和水解物来生长。自然源性的培养基可含有大量化合物。它们还含有微量营养素。
由于几个原因,可变性可能在培养基中蔓延。培养基中存在的原料、杂质和污染物的降解;大批量生产中,由于微量营养素的损失,导致研磨和混合不均匀;由于可用性的限制,含量水平的不一致和原材料采购的变化会导致原材料的可变性。虽然在过去的十年中已经转向使用化学限定的培养基,但天然培养基继续被行业使用,并继续为保持一致的产品质量提供挑战。即使是化学限定的培养基也有复杂的组成,这就需要对其进行表征、以达到一致的工艺性能。
赋形剂质量不一致会对药品质量产生不良影响。赋形剂源性的污染物可分为以下几类:微量金属、过氧化物、醛类、还原糖/多元醇和有机酸。这些赋形剂的纯度水平可能会有很大差异,并在不同程度上影响产品的质量/稳定性。即使是纯赋形剂,在储存过程中也可能通过各种降解途径而产生污染物。例如,聚山梨酸酯会发生自氧化,从而影响生物制药产品的稳定性。容器/封闭系统的析出物已被证明对产品质量有重大影响,最近的一些问题证明了这一点:玻璃小瓶中的玻璃薄片、预填充注射器中的钨、小瓶塞或预填充注射器桶中的硅、过滤器中的析出物以及灌装泵溶液接触表面的纳米颗粒脱落。层析填料的批次间差异也可能导致产量或产品质量的意外变化。
基于QbD的原材料管理方法
国际协调会议 (ICH) 在其Q7良好生产规范、Q8药物开发、Q9质量风险评估和Q10药品质量体系指南中对产品质量提出了严格的要求。现行的原料分析方法在ICH Q7指南中有描述。该文件指出,用于制备活性药物成分 (小分子和生物制剂) 的材料需要在收到时确认每个批次的标识,并提供供应商提供的分析证书 (CoA)。药典和处方专著,如USP/NF、EuP、JP和BP,为最常见和广泛使用的材料提供了标准化的测试方法。制造商采用各种方法来测试原材料的合规性。一些公司通过对原材料供应商进行初步详细的供应商审核,然后根据药典各论对三批原材料进行年度鉴定,从而对原材料供应商进行质量确认。如果合格批次测试成功,那么随后的材料出货将只需要各论鉴定测试。然而,对原材料放行采取更为保守的方法的公司要求对每批供应的材料进行全面的专著测试。此外,根据对供应商设施的审核,供应商必须是合格的,其分析结果必须是可靠的,并且每种来料都需要一个抽样计划。
关键/重要原材料 |
↓ |
了解其对工艺和产品的“影响” |
↓ |
识别原材料的关键属性 |
↓ |
创建关键属性特征的分析方法 |
↓ |
收集数据对原材料进行指纹识别 |
↓ |
实施方法以识别可接受和不可接受的原材料批次 |
图1. 在QbD范式中管理原材料
一个关键的挑战是用于生物制药生产的相对较大的原材料数量 (通常> 100)。为了有效地处理如此大量的原材料,已经提出了一种基于QbD的多步骤方法 (图1)。建议在产品开发的每个主要里程碑 (动物试验、I期、II期、III期和验证) 进行这种评估。虽然第一次执行时是一项艰巨的任务,但由于大多数原材料在同类产品 (例如单克隆抗体) 中是相同的,因此在接下来的时间内工作量大大减少:
对工艺中使用的所有原材料进行风险评估。有许多不同的风险评估工具,其细节和复杂性各不相同,重要的是要使用适合评估目的的方法。适当的涉众,如工艺开发、生产、质量保证和质量控制,都包括在这个评估中。团队讨论原材料是否有可能影响工艺性能,是否有可能影响产品质量。那些可能影响两者的被称为关键原材料,那些只影响工艺过程而不影响产品的被称为重要原材料,那些预计不会影响任何一方的被称为非关键原材料。
然后,关键原材料被彻底表征,其与过程相互作用的机制被很好地理解。制造商应该了解原材料是如何影响生产过程和产品的。需要识别可用于表征这种影响的原材料属性,并建立这些属性的可接受标准。需要开发分析测试来监控这些属性,以确保每个关键原材料批次在使用前符合各自的验收标准。
重要原材料的表征可以与关键原材料相同,但关键原材料对每个产品都要进行这种分析,而重要原材料需要对一个平台进行一次表征分析。每次将新的重要原材料添加到平台上,在使用前都会对其进行彻底的表征。
非关键原材料包括剩余 (和大部分) 原料,并通过生物制药制造商的内部质量体系进行处理,就像传统制药一样。
评估可变性的工具
基于原材料如何影响工艺过程和产品质量的详细表征的原材料指纹为上述难题提供了一个潜在的解决方案。便于对原料质量进行高效且有效的监控,防止对产品质量产生重大不利影响。
分析工具
对原材料的评估涉及到使用广泛的分析技术,如光谱、色谱和基于酶的工具。光谱技术是快速的,并已被证明可以相当有效的监测原材料质量中的变化,因此是首选的工具。拉曼光谱、近红外光谱(NIR)、傅里叶变换红外光谱(FTIR)、中红外光谱(MIR)、荧光光谱和核磁共振 (NMR) 已被用于原材料的鉴定和表征。研究人员最近评估了几种光谱技术用于检测生物制药制剂中常用的两种赋形剂 - 三甲胺(Tris) 和盐酸三甲胺(Tris- HCL) 的掺假的能力和适用性。对近红外(NIR)、拉曼(手持式拉曼和拉曼显微镜)、傅里叶变换红外(FTIR)和核磁共振(NMR)进行了评估,并在分析速度和区分掺假和未掺假样品的能力方面强调了它们的优缺点。在其它研究中,质谱 (MS) 已被证明具有显著的高灵敏度,但用于常规原材料的放行检测是昂贵的,而且执行起来也很麻烦。金纳米颗粒表面增强拉曼光谱 (SERS) 已成功用于检测蛋白质制药原料中的微量三聚氰胺。最近的一篇综述提供了一份广泛的工具清单,其用于生物制药生产中细胞培养基的可变性来源检测,以及它们的优点和缺点。表1总结了这些信息。其它替代方法包括印迹法、毛细管电泳法(CE)、酶法 (如酶联免疫吸附试验 (ELISA) )、高效液相色谱法(HPLC)、气相色谱法和SDS-PAGE。蛋白质组学分析也被提议作为评估复杂原材料 (如血清) 的工具。蛋白质组学技术用于了解细胞培养过程中对生长特性影响的批次间可变性。作为该方法的延伸,蛋白质组学与代谢组学相结合已被用于确定细胞培养过程中生产力低下的根本原因。该分析将观察到的细胞培养性能下降的因素归结为由于Cu水平升高 (作为培养基成分中的污染物) 而导致的缺氧。
统计在数据分析中的作用
来自生物制药生产的数据集,包括光谱工具,通常很复杂,因此单变量或双变量分析是不充分的,并且可能导致错误的结论。在大多数情况下,需要使用多元数据分析 (MVDA) 来描述大型多因素和多重共线数据集中的相关信息。MVDA 涉及使用工具进行探索性数据分析(数据挖掘)、分类(聚类分析)、回归分析和预测建模。投影方法通常用于克服数据集的多维性、多重共线性、缺失数据以及由偏差因素(例如实验误差和噪声)引入的其它变化。一种这样的技术是主成分分析 (PCA),它通过分解数据集的协方差矩阵来找到数据集中的主要可变性方向,以用几个组件解释整个系统的行为。当需要探索一个或多个响应变量的多元相关性时,会使用各种回归技术,如主成分回归、偏最小二乘法 (PLS) 和岭回归。PLS 通过减小它们的大小、同时最大化它们之间的协方差,来重新排列过程变量空间和响应变量空间。原材料库的特征数据可能包括一个或多个分类响应变量,这需要使用 PLS 的一种变体,称为 PLS 判别分析 (PLSDA) 。连续变量数据包含预测信息和不相关信息,使用正交 PLS (OPLS) 可以改进模型的诊断和解释性。基于 PLS 和 PCA 的批量建模常用于生物技术行业处理批次操作数据。
实验设计 (DoE) 是规划实验研究的选择方法,这样可以使用最少数量的实验来获得相关的过程信息。它提供了有关因素相互作用和整个系统行为方式的信息。它显示了相互关联的因素如何在一个广泛的值范围内响应,而不需要直接测试所有可能的值。因此,它在不影响结果质量的情况下减少了进行许多运行的工作量和成本。
MVDA为光谱数据分析提供了一种有效的方法。应用包括预处理方法,以减少和纠正光谱数据中的干扰,如重叠带、基线漂移、散射和路径长度变化。还可采用统计方法进行校准诊断和变量选择,统计结果计算以建立具有代表性和可靠性的模型,并对模型进行验证和集成,以实现严格的预测和实时的产品质量和过程监测。
原材料指纹识别的最新趋势
在最近的研究中,光谱学和化学计量学的结合被用来表征原材料的可变性,并根据原材料的信息预测最终产品的质量。由于细胞培养原材料是复杂的混合物,因此很难识别和量化存在的每种化合物。拉曼、中红外、近红外和荧光等光谱工具与化学计量学相结合,足以表征复杂的原材料。NIR 光谱与 PCA 相结合已被证明可有效地对细胞培养基组分进行指纹识别,从而区分性能好和差的培养基批次。在 Lee 等人最近的另一项研究中,分析了多个大豆水解产物批次的 NIR 光谱,并通过使用化学计量学方法表明,NIR 光谱可用于揭示批次之间以及供应商之间的差异。利用近红外光谱建立了基于偏最小二乘回归(PLSR)的哺乳动物细胞培养物生长和产率预测模型。
此外,在确定新原材料对细胞培养性能的影响时,评估多个光谱平台的性能是很重要的。有研究表明,近红外光谱和2D荧光光谱都可以检测基础培养基的成分变化,发现基础培养基的老化会影响细胞培养性能,因此近红外光谱和2D荧光光谱都可以评估基础培养基储存后的质量。另一项类似的研究表明,近红外和2D荧光光谱能够检测培养基成分的批次差异。
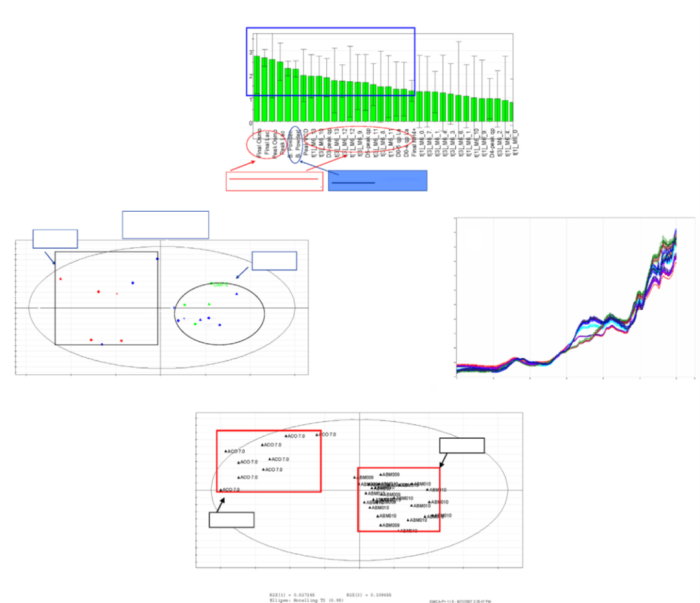
QbD范式下原材料管理的案例研究。(a) 多变量数据分析表明临床生产 (组2) 和商业化生产 (组1) 存在差异。(b) 根本原因分析表明基础培养基的差异是工艺可变性的主要来源。(c) 基于近红外光谱的原材料指纹识别方法的开发。(d) 近红外光谱法能够区分“好” (组B) 和“坏”(组A)的批次。
研究人员认为,在很多情况下,单一光谱可能不足以表征原材料,可能需要结合多种正交光谱技术来实现所需的特异性和准确性。已经提出了光谱和非光谱技术的多种组合来表征复杂的原材料。研究人员已经展示了使用气相色谱-质谱分光光度法 (GC-MS) 方法对复杂的无血清细胞培养基中的脂质进行微量定量,确定为脂肪酸甲酯 (FAME) 。其他研究人员建议结合使用亲和层析(Protein G 或Protein A)、SDS-PAGE 和肽质量指纹图谱来分析细胞培养基中是否存在污染性牛抗体。液相色谱-质谱 (LC-MS) 技术也已应用于多种培养基成分的同步定量。最近,研究还探索了基于化学计量学的数据融合方法,以支持的不同光谱工具的组合。在一项这样的研究中,多个光谱平台(NIR、拉曼、荧光和 X 射线荧光)在估计能力方面相互比较,然后集成到一个统一的预测模型中。结果表明,数据融合模型比单独的光谱方法表现出更好的预测准确性,证明了数据融合在表征原材料质量方面的协同效应。
原材料指纹识别的案例研究
来自一家大型生物技术公司的研究人员报告了一个哺乳动物细胞培养从临床规模 (2,000 L)到商业化规模(15,000 L)的技术转移和规模放大过程中面临的重大问题。该案例研究如图2所示。商业规模生产的产品的CQA与临床规模生产的CQA有显著差异。进行了广泛的调查,以确定根本原因。根本原因被确定为同一供应商为两种操作规模提供的基础培养基的差异。在供应商现场的进一步调查得出的信息是,在碾磨和混合过程中,培养基成分的分组随生产规模和培养基类型而变化,从而产生不同的特征。考虑到原材料的显著影响,基于对工艺性能和产品属性的影响,创建了一种基于近红外的方法来筛选大量基础培养基粉末。结合NIR/MVDA方法可以对原材料进行指纹识别,以区分表现良好和表现不佳的培养基批次。
总结
监管反馈导致生物制药行业对原材料及其管理的看法发生了重大转变。大多数主要制造商正在应用风险分析和良好科学的原则来确定关键原材料及其分析特性。在过去十年中,对关键原材料进行准确指纹识别的概念也得到了发展。本文中提出的在QbD范式中逐步管理原材料的方法可能会大大提高我们对该主题的理解。尽管在过去十年中已经取得了很多成就,但我们在原材料表征方面仍然远远没有达到与我们在工艺表征方面相同的严格程度。不断向系统中添加新的原材料将使这项任务仍具挑战性。
原文:A.S.Rathore, D.Kumar, N. Kateja, Role of raw materials in biopharmaceutical manufacturing: risk analysis and fingerprinting. Current Opinion in Biotechnology, 2018.
内容来源:生物工艺与技术
责任编辑:胡静 审核人:何发
热点文章
-
中国GMP|2025年新版无菌药品附录(征求意见稿)到底有哪些变化?
2025-04-10
-
案例研究:FD820C嵌入式微型差压变送器在制药洁净室中的卓越应用
2025-02-27
-
科普 | 一文读懂什么是合成生物学
2025-02-14
-
抗体偶联药物的偶联技术全面梳理
2025-03-04
-
一文读懂GMP文件管理全生命周期合规要求
2025-02-14
-
替尔泊肽制备工艺过程
2025-03-11
-
阿斯利康掏10亿美元腰包! EsoBiotec的体内CAR-T究竟是何方神圣?
2025-03-27
-
药品密封性检测 :用户需求与优化
本文从用户角度出发,全面而深入地剖析了无菌药品密封性检测技术。通过分析用户在实际应用过程中的需求、体验和遇到的问题,为制药企业选择合适的检测技术提供科学且实用的参考依据,同时为检测技术供应商改进和创新产品提供方向指引,促进无菌药品密封性检测技术的不断优化和发展,从而更好地保障无菌药品的质量安全。
作者:付沛林、王明建、王亮
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
-
洁净服 :材料、设计与行业应用解析














评论 0
没有更多评论了