【原创】洛尔类原料药:工艺开发的共性问题分析
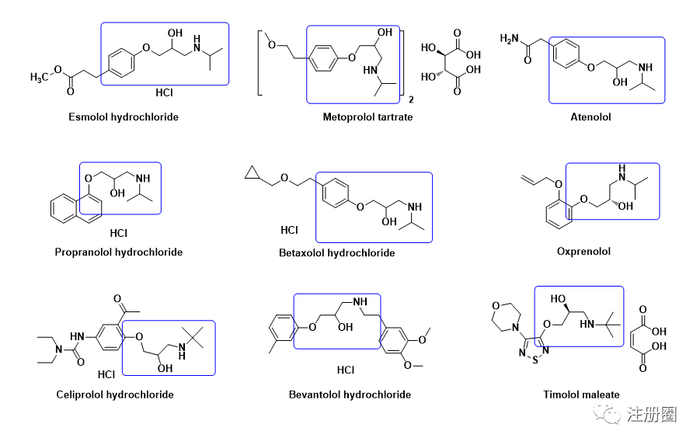
工艺开发的共性问题分析
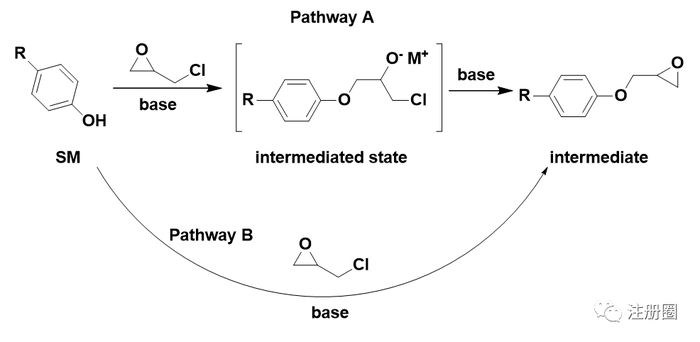
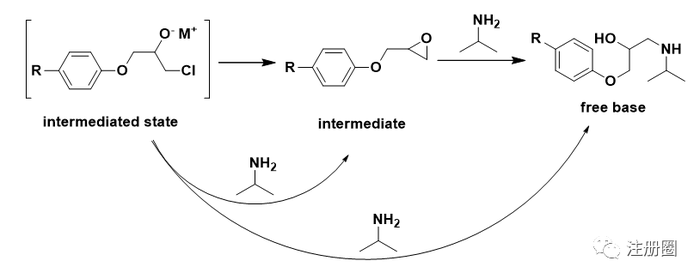
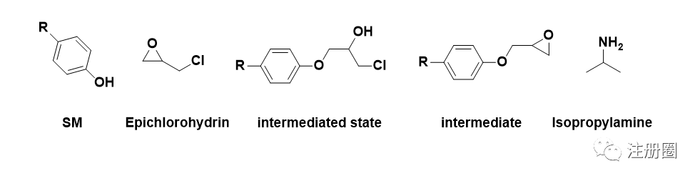
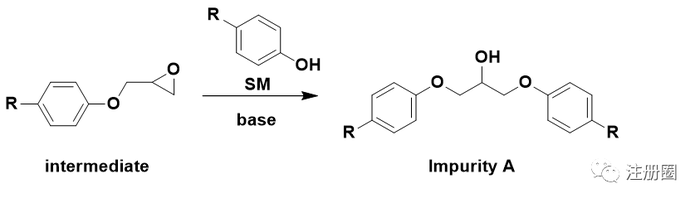

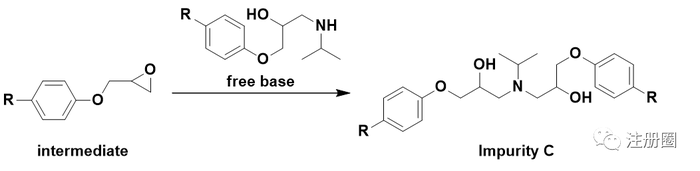
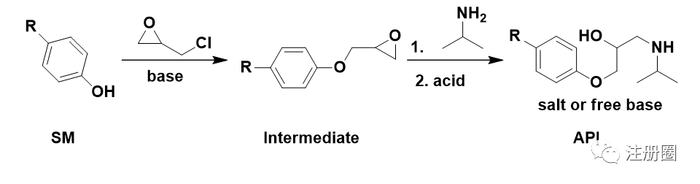
无论是环氧氯丙烷自身,还是环氧氯丙烷中可能含有的杂质,或含有环氧结构,或含有氯原子,均带有警示结构。中间体的环氧结构和中间态的氯也带有警示结构。
内容来源:注册圈
责任编辑:胡静 审核人:何发
热点文章
-
中国GMP|2025年新版无菌药品附录(征求意见稿)到底有哪些变化?
2025-04-10
-
案例研究:FD820C嵌入式微型差压变送器在制药洁净室中的卓越应用
2025-02-27
-
科普 | 一文读懂什么是合成生物学
2025-02-14
-
抗体偶联药物的偶联技术全面梳理
2025-03-04
-
一文读懂GMP文件管理全生命周期合规要求
2025-02-14
-
替尔泊肽制备工艺过程
2025-03-11
-
阿斯利康掏10亿美元腰包! EsoBiotec的体内CAR-T究竟是何方神圣?
2025-03-27
-
药品密封性检测 :用户需求与优化
本文从用户角度出发,全面而深入地剖析了无菌药品密封性检测技术。通过分析用户在实际应用过程中的需求、体验和遇到的问题,为制药企业选择合适的检测技术提供科学且实用的参考依据,同时为检测技术供应商改进和创新产品提供方向指引,促进无菌药品密封性检测技术的不断优化和发展,从而更好地保障无菌药品的质量安全。
作者:付沛林、王明建、王亮
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
-
洁净服 :材料、设计与行业应用解析














评论 0
没有更多评论了