ADC 爆火背后超70%外包, 迈百瑞一站式 CDMO 助力药企占据先势
从 ADC 的市场销售来看:
自 2019 年,全球 ADC 药物市场进入高速增长阶段。
由阿斯利康和第一三共开发的DS-8201于2019年底获批上市,用了3年时间便迈过 10 亿美元大关,而 TDM-1(Trastuzumab-Emtansin ,曲妥珠单抗—美坦新偶联物)从 2013 年被美国 FDA 批准上市,到销售额突破 10 亿美元,用了近 5 年。
据 Nature 子刊预测,到 2026 年,全球 ADC 药物市场规模将达到164 亿美元,成为百亿美元级别的重磅市场。
火爆的市场背后是制药人对 ADC 治疗药物的认可、丰富的研发/产品管线的有力支撑。据不完全统计,目前全球在研 ADC 药物超过 600 个,其中国内有 240 多个;截止到 2022 年底,全球已有 15 款 ADC 药物获批上市。ADC 药物也被认为是继 PD-1 之后的下一个“黄金”赛道。
基于 ADC 药物开发的挑战性,对其 CMC 工作,70% 以上的药企选择外包。

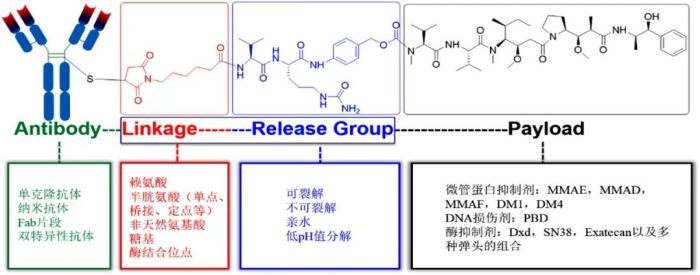
ADC (Antibody-Drug Conjugate),即抗体偶联药物,因其精准强效,也被业内称为“智能生物导弹”。其包含一个特定靶向抗体(Antibody),能够精准靶向病变细胞;一个称为有效载荷的细胞毒素(Payload),用来加强杀伤肿瘤细胞的能力;还有抗体与 payload 形成的偶联物。
此组合设计,既可降低脱靶毒性,又能增强对靶细胞及组织的杀死性。与单独使用抗体或小分子药物相比,ADC 能帮助实现 1+1>2 的治疗优势。

尽管 ADC 药物经历了目前公认的三代变革,技术日臻成熟,但其复杂的结构及对新的靶向分子、payload 及连接子、偶联方式等的不断研究改进,致使ADC 药物在工艺开发与商业化生产等方面更具有挑战性。
靶向分子、payload、靶向分子与 payload 的偶联,一般需要分别进行工艺开发及生产。
工艺开发过程中需要兼顾不同组分的独特产品特性,还需要研究偶联过程中的相互作用及对产品质量的影响,工作复杂且工作量大,大概是传统大分子药物研究的 2-3 倍。ADC 药物的制剂研究也面临很大的挑战,比如,对于偶联物,由于 payload 及偶联方式的不同,改变了靶向大分子的特性,像疏水性、电荷异质等;有些情况下,payload 容易从靶向大分子上脱落下来,造成产品不稳定与用药时的非特异毒性。
在商业化生产方面,研发企业很难同时兼备靶向大分子、payload 以及偶联药原液和制剂的生产能力,如何解决工艺开发和商业化生产的双重挑战,成为摆在 ADC 药物研发企业面前的重大课题。

正是由于 CMC 工作方面的挑战,目前大部分正在研发的 ADC 药物都在专业的 CRO 或 CDMO 进行 CMC 的工作,据默沙东的 ADC 基地于 2022 年 9 月发布的统计数据显示,比例超过 70% 。
对于 ADC 药企来说,选择与 CDMO 合作,使其提供 ADC 药物从研发到商业化全流程服务的一站式 CDMO ,在降低风险/成本、缩短周期方面具有更大的优势。
CDMO 竞争格局形成,谁能拔得头筹?
国内 ADC CDMO 竞争格局已经明朗化,拥有先发优势的迈百瑞成为赛道的领跑者之一。
中国率先上市的原创 ADC 药物——荣昌生物维迪西妥单抗(RC48)的早期临床样品,由迈百瑞提供。2020 年 10 月,迈百瑞 M1 生产设施顺利通过了 CDE 对维迪西妥单抗产品上市前的生产现场核查。
截至目前,迈百瑞在全球获得 40 多个 ADC 综合项目的合作,已有13 个 ADC 项目获得临床批件。除此之外,迈百瑞每年累计为客户提供 400 多个ADC 分子用于体内/体外的药效评价以及安全性评价等。
创新型研发平台,紧随行业前沿
自成立起,迈百瑞便布局搭建 ADC 研发平台,目前已拥有新型连接子-毒素的研发设计、偶联技术的开发与新一代 XDC 候选药物筛选的技术实力,并已掌握各类成熟的偶联技术和行业内新兴的偶联技术,例如赖氨酸偶联、半胱氨酸偶联、酶催化偶联、非天然氨基酸偶联、糖基化位点偶联等。项目成功率 100%,技术转移迅速,工艺稳健。

迈百瑞成熟的分析方法开发平台,具有完整的 ADC 药物分析能力,能够快速开发出针对 ADC 特异性的分析方法;按照药典及 ICH 指导原则进行分析方法开发、转移及确认,具有丰富的方法开发和申报经验,并持续引进新技术优化平台。
作为大分子药物和小分子药物的结合体,ADC 药物的开发需要企业同时具备两方面的能力。如果建立独立的研发生产设施,按照单品种 2000L 规模计算,抗体、Linker-Payload、ADC 原液、ADC 制剂等GMP 生产设施,投入的费用需要 5 亿元左右。
所以,尽管 ADC 研发企业众多,目前已独立建厂的却很少,即使是 CDMO 企业也多选择投建某一环节,在一厂之内能够提供 ADC 药物从研发到生产的企业,在全球范围内都是少数。

如果一个 ADC 药物从研发到生产由多个供应商完成,需要进行多次技术转移,甚至辗转多地,这必然会导致风险的提高和成本的增加。因此,ADC 药物开发最佳的选择就是一厂之内完成研发和生产。
迈百瑞在烟台厂区建成了抗体、Linker-Payload、ADC 原液、ADC 制剂等 GMP 生产设施,可在一个厂区内完成全部 ADC 药物 CDMO 服务,在降低风险和成本的同时,还可有效缩短项目周期。

迈百瑞 烟台厂区
独立的 Toxin/Linker-Toxin 合成车间,VC-MMAE 生产规模 200g /批,已获得 DMF 备案(035537)
已完成四种不同 Linker- Payload 的工艺开发,并且成功从毫克级放大生产至百克级
最大偶联规模达到 150L,并预留 500L 反应釜工位,充分满足商业化需求
独立的 ADC 制剂产线,提供商业化注射剂及冻干粉针灌装,可处理 2ml、10ml、20ml、50ml 规格的西林瓶
已完成 100 多批次 ADC 药物生产,成功率 100%
完善的 GMP/cGMP 质量管理体系,累计接受 100 余次国内外审计和检查,均顺利通过
 Toxin/Linker-Toxin 合成车间
Toxin/Linker-Toxin 合成车间

冻干机
定制化服务,提升差异化竞争优势
ADC 已成为创新药产业里最炙手可热的细分领域,国内外药企研发热情持续高涨,这也意味着竞争会越来越激烈。如何成功完成研发,快速上市,并最大化兑现商业价值,是摆在企业面前的现实问题。
依托于长期的技术与行业经验积累、全面的平台工艺、商业化生产设施、完善的质量管理体系,迈百瑞已顺利完成了 ADC 药物从研发到生产一体化服务的经验积累。同时,迈百瑞建立的研发/生产平台在支撑 CDMO 业务运营方面具有技术的共通性,能够以药物 CMC 研究阶段的任一步骤作为切入点,满足不同客户的差异化需求,最大限度提升产品竞争优势。
内容来源:E药经理人
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多