收藏 | 对照品开瓶后稳定性考察
近两年,国家药品监督管理局(NMPA)的现场核查工作中越来越频繁地提及“对照品开瓶次数稳定性”。从风险控制的角度,对于一些物理性质不稳定(如易吸湿、挥发等)或化学性质不稳定(如易氧化、水解、光/热不稳定等)的对照品,随着开瓶次数的增多,对照品质量确实有变化的风险。
QC实验室用于检验的对照品分为单次使用和开瓶后多次使用,对于开瓶后多次使用的对照品需要进行开瓶后稳定性考察评估其适用性。
QC实验室评估出易受影响的5种对照品进行周期1年、开瓶次数15次的稳定性考察。5种对照品稳定性检验考察结果均符合可接受标准,根据对照品稳定性考察结果起草此稳定性考察报告。
SOP对照品(标准品)的管理对于对照品的储存和使用有如下要求:
已开瓶对照品(标准品)应储存于保干器中,同时确保保干器内的硅胶是有效的。
非室温条件贮存的对照品(标准品)从存放处取出后,放置于平衡对照品(标准品)用的保干器中,平衡半小时至室温后使用。
称量对照品(标准品)时应认真仔细,尽量迅速操作,缩短容器开口时间,使用的称量器具应洁净无污染,已经取出的对照品(标准品)不能再倒回到容器中以避免交叉污染。使用后应立即将对照品(标准品)的容器密封并放回到指定的存放处(标签要求的储存条件)。
评估开瓶后对照品的储存和使用规定,识别其过程中可能产生对照品质量变化的风险因素有:对照品中的水分和残留溶剂等易挥发性物质的挥发、具有引湿对照品吸收环境中的水分、易氧化对照品被空气中氧气氧化、对光敏感的对照品在称量过程中见光发生变化、易受温度影响的对照品在平衡至室温的过程中发生反应。
从实验室所有需要多次使用对照品中选取对上述影响因素敏感的对照品进行考察,支持对照品的开瓶后使用期限和频次(考察的使用期限为1年使用频次为15次)。
分别对实验室已开瓶对照品(开瓶时间至少1年)和首次开瓶对照品各一瓶进行测定,每瓶平行制备两个样品每个样品进样2次,对比四次结果平均值的相对偏差。
注:如已开瓶对照品开瓶次数不足15次,采用模拟开瓶的形式,使其开瓶次数达到15次。
使用洁净称量勺将稳定性考察对照品搅拌之后开瓶放置至少2分钟,然后盖上瓶塞,将其放回指定的存放处。所有操作按照SOP 对照品(标准品)管理规定进行。
(首次开瓶对照品保留时间平均值—已开瓶对照品保留时间平均值)*100%/首次开瓶对照品保留时间平均值
(首次开瓶对照品峰面积与其称样量比值的平均值-已开瓶对照品峰面积与其称样量比值的平均值)*100%/首次开瓶对照品峰面积与其称样量比值的平均值
实验室部分对照品所用的物料中含有水分和残留溶剂等易挥发成分,对照品开瓶后在储存和使用过程中,可能导致易挥发成分挥发,使对照品的纯度升高。
选取实验室对照品中水分和残留溶剂含量最高的对照品进行考察,选取结果如下:
已开瓶对照品和首次开瓶对照品色谱峰保留时间相对偏差值不大于±3%。
已开瓶对照品和首次开瓶对照品峰面积与称样量比值的相对偏差不大于±5%。
实验室部分对照品具有引湿性,对照品开瓶后在储存和使用过程中可能吸收环境中的水分,导致对照品的纯度降低。
选取实验室具有引湿性的对照品进行考察,选取结果如下:
已开瓶对照品和首次开瓶对照品色谱峰保留时间相对偏差值不大于±3%。
已开瓶对照品和首次开瓶对照品峰面积与称样量比值的相对偏差不大于±5%。
实验室部分对照品含有易氧化基团(例如羟基),对照品开瓶后在储存和使用过程中,可能被空气中的氧气氧化,导致对照品的纯度降低。
选取实验室含有易被氧化基团的对照品进行考察。选取结果如下:
已开瓶对照品和首次开瓶对照品色谱峰保留时间相对偏差值不大于±3%。
已开瓶对照品和首次开瓶对照品峰面积与称样量比值的相对偏差不大于±5%。
实验室部分对照品对光敏感,对照品开瓶后使用过程中可能受光影响,导致对照品的纯度降低。
选取实验室容易发生光学转化的对照品进行考察。Sertraline Hydrochloride Racemic Mixture是盐酸舍曲林的外消旋体,需要避光保存,选取Sertraline Hydrochloride Racemic Mixture 用于光学稳定考察。
已开瓶对照品和首次开瓶对照品色谱峰保留时间相对偏差值不大于±3%。
已开瓶对照品和首次开瓶对照品峰面积与称样量比值的相对偏差不大于±5%。
实验室部分对照品对温度敏感,需要冷冻储存(-15℃ orbelow),对照品在使用过程中需要平衡至室温,此过程可能导致对照品成分变化使纯度降低。
选取实验室对照品中对温度敏感即需要冷冻储存的对照品。选取结果如下:
已开瓶对照品和首次开瓶对照品色谱峰保留时间相对偏差值不大于±3%。
已开瓶对照品和首次开瓶对照品峰面积与称样量比值的相对偏差不大于±5%。
3.1氧化因素考察时新开瓶对照品两个平行样品中的一个样品峰面积异常
化验员查看氧化因素考察数据时,发现新开瓶对照品(SL 56322)两个平行样品中的一个样品峰面积异常,两个平行样品之间的控制为85%,具体数值如表11。因此发起偏差调查。
注:控制=样品1峰面积平均值*样品2称样量*100%/样品2峰面积平均值/样品1称样量
化验员回顾整个实验过程,未发现异常情况,检验数据已经过复核。
将新开瓶对照品峰面积异常的样品1初始液相小瓶内的样品重新进样运行,SL 56322峰面积为24992与初始检验基本一致,排除仪器偶然波动等原因引起。
将新开瓶峰面积异常对照品的样品1初始容量瓶中的样品重新过滤进样运行,SL 56322峰面积为29238,与平行样品2的峰面积数值平行,样品1和样品2控制为100%。此结果说明容量瓶内的对照品溶液以及此新开瓶的对照品无异常。
通过上述调查,新开瓶对照品两个平行样品中的一个峰面积异常排除对照品原因引起,不排除对照品溶液过滤或转移至液相小瓶过程中,过滤器或液相小瓶中溅入稀释液导致。重新制备一个新开瓶对照品样品代替峰面积异常样品进行检测,结果满足可接受标准。具体结果见下表12。
通过对各影响因素敏感的对照品的开瓶后稳定性进行考察(考察使用期限为1年使用频次为15次),考察结果均符合可接受标准。此五种对照品的考察结果可支持对照品开瓶后使用期限1年和使用频次15次。
由于各种对照品的性质、每次使用的环境、使用的间隔周期、使用的量、瓶子敞口时间长短等都可能不同,想要严谨地模拟真实的日常使用过程,设计实验方案研究对照品的开瓶次数稳定性,其实存在较大难度。哪怕一些从官方机构(USP、ChP、EP等)购入的一级对照品,官方机构提供的对照品稳定性也仅仅是密封保存状态下的稳定性,不会提供对照品的开瓶次数稳定性数据。不过除开风险控制方面,其实开瓶次数稳定性一定程度上还可以指导对照品(尤其是自制对照品)的装量规格。笔者结合自己的工作经验,以及请教了部分在中国内地、香港、美国药企工作的老同事,整合了一些对照品开瓶次数稳定性研究的方式以及思考,见以下各表。
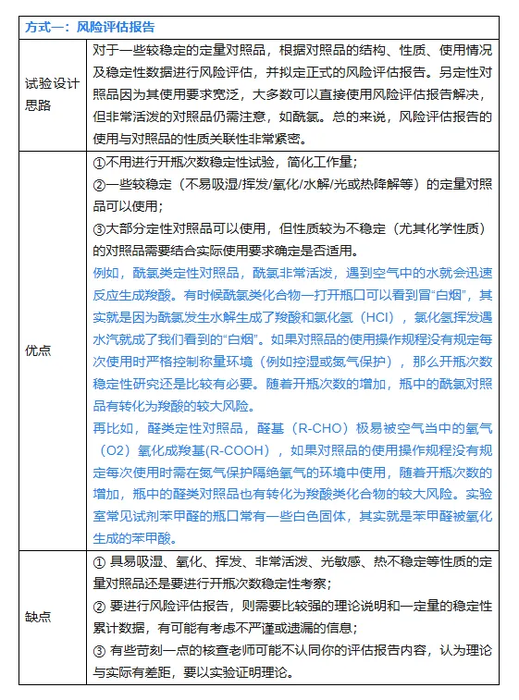

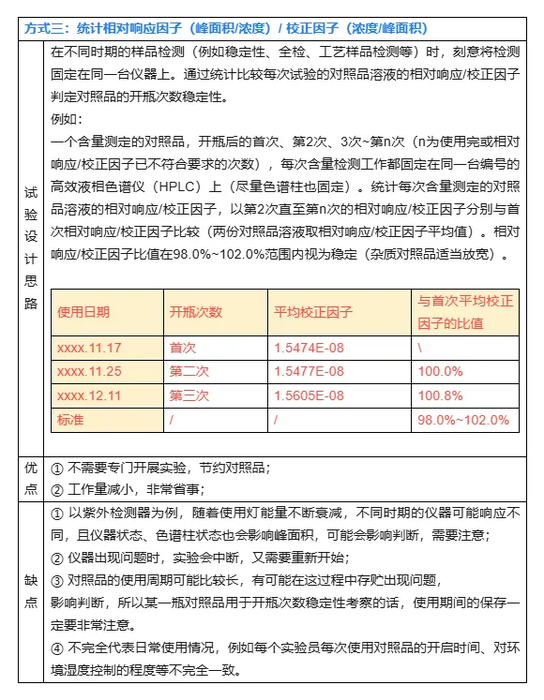
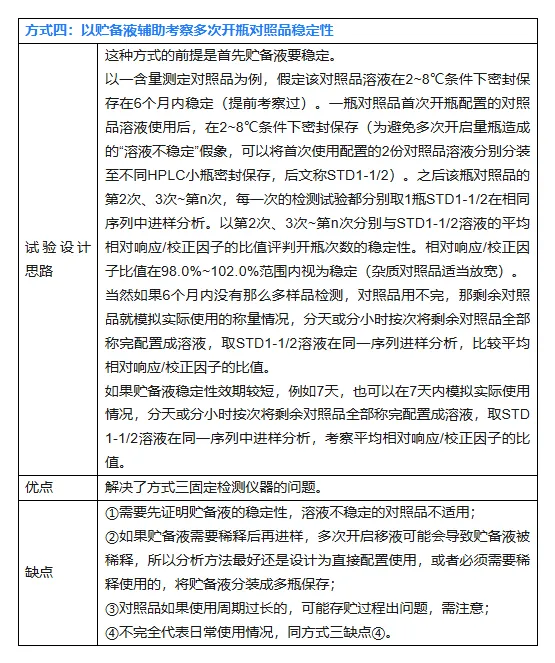

对照品开瓶次数稳定性的考察,由于变量太多,完全模拟出实际使用情况的其实较难,以上几种方式多少都有其一定的局限性,但也有其指导意义。以上几种方式不是完全独立,可以互相结合起来研究。例如方式三在第4次试验时发现仪器坏了,完全可以新开瓶对照品考察第4次开瓶的稳定性,仪器修好了又接着以方式三继续考察。方法是死的,人是活的,实验研究设计只要科学、合理,很多事情都可以灵活变通。
作者个人觉得,最严谨又最节约对照品的方式,可能是方式四+方式六,但对照品溶液不稳定的对照品,最严谨方式可能是方式五+方式六的结合。即基本方式同方式四或方式五,只是在每次对照品使用时增加敞口15min(根据具体品种具体制定)的操作,尽量覆盖日常使用时的极端条件。但是企业要考虑成本,在实验设计完美与成本控制之间找到一个平衡点,也是值得思考的地方。
分析与GMP、注册圈
邵丽竹
何发































评论
加载更多