FDA 检查现状:检查员流失,海外突击检查继续实施,将对中国开展独立口译员试点
从这份报告中我们还可以更为全面的了解过去一年中 FDA 对于中国检查的实施现状,以及未来计划采取的新行动。
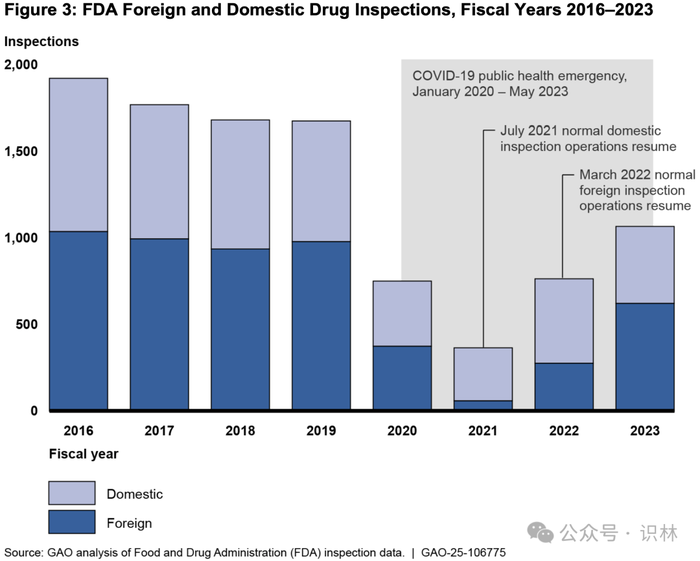
总的来说,GAO 表示,在从新冠疫情造成的制药生产现场检查积压中部分恢复后,FDA 在 2023 年进行的检查次数仍比 2019 年少 36%。(见下图)
报告称,FDA 药品检查员的空缺职位从 2021 年 11 月的 25 人(总共约 250 名检查员)增加到 2023 年的 73 人。
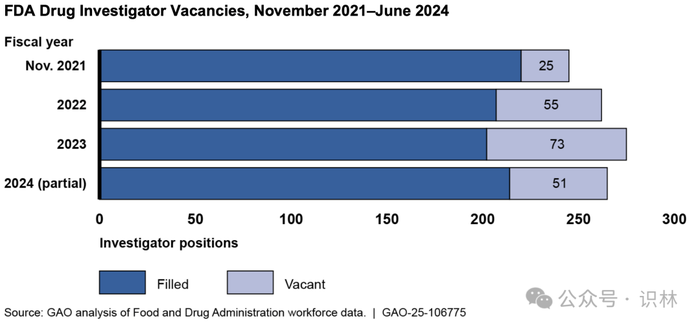
尽管 FDA 已针对疫情后的检查员空缺进行调查,但 GAO 表示,“自那以后,检查员的流失率普遍高于招聘速度,导致大量调查员缺乏经验”,这限制了 FDA 可以进行的检查数量。GAO 表示,主要原因是“旅行频率和条件、薪酬、培训不足、工作量大以及工作与生活的平衡问题”,尽管 FDA 正在采取措施解决薪酬和培训问题。
下面我们重点来看看报告中与我国企业密切相关的部分。
对印度和中国进行了最多的海外检查
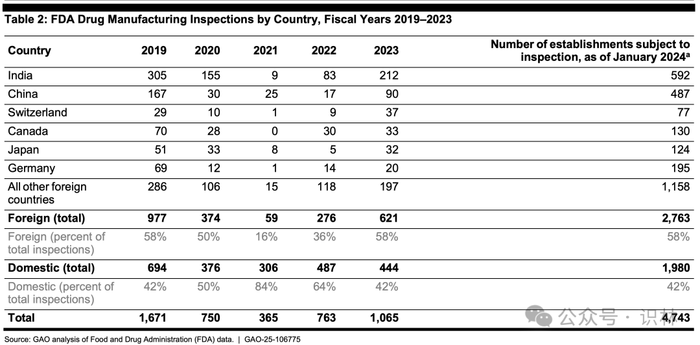
根据 GAO 对 FDA 数据的分析发现,虽然自 2020 年疫情爆发以来,FDA 主要在美国本土进行检查。但到 2023 财年,58% 的药品检查针对的是海外设施,与疫情爆发前 2019 财年海外检查比例相同。同样,在 2023 财年,FDA 再次在印度和中国进行了最多的海外检查,总共有近 40% 的海外场地位于这两个国家。(见下表。)
突击检查试点
FDA 于 2022 年 3 月开始实施突击检查试点计划。FDA 在对试点设计和实施的过程中接受了 GAO 先前报告中提出的建议。据 FDA 称,由于与新冠疫情相关的旅行限制、新的签证申请流程以及中国有关间谍和国家安全的新法律,试点在中国的实施速度有所放缓。此外,FDA 表示,试点检查的资源需求增加影响了实施速度。具体而言,FDA 决定出于安全原因,试点中的突击检查将由两名检查员组队进行(历史上,大多数检查都是由单独检查员进行的)。
根据 FDA 关于试点状态的报告,截至 2024 年 5 月,FDA 已在印度启动了 114 次试点检查(其中 94 次为突击检查),在中国启动了 28 次试点检查(其中 16 次为突击检查)。FDA 计划在每个阶段继续试点实施,直到在两个国家完成总共约 250 次突击检查和约 250 次预先通知的检查。
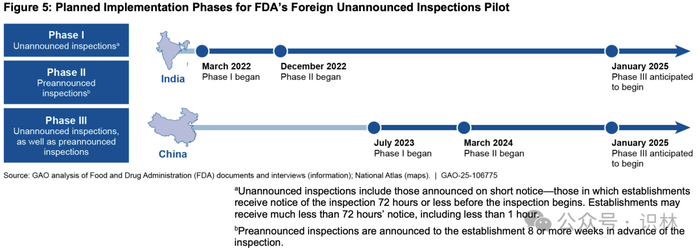
FDA 计划在每个国家的每个阶段结束时进行评估,预计在两个国家的所有阶段完成后才会完成最终评估,FDA 官员预计这将需要几年时间。FDA 于 2023 年 4 月完成了对印度试点第一阶段的内部评估,并获得了许多见解。例如,在试点第一阶段在印度启动的突击检查中,FDA 指出了以下两点。
有两次当 FDA 到达机构时,另一个国家的监管机构已经在现场。根据评估,在这些情况下,FDA 和企业没有遇到任何检查重叠方面的挑战。
两次检查无法按计划完成。在启动检查时,FDA 确定一家企业已停业。第二家企业处于进口禁令状态,企业工作人员告诉 FDA 检查人员,该企业尚未准备好接受检查。在这两种情况下,第二天检查人员都被重新分配到另一家企业进行突击检查。
据 FDA 称,在这两种情况下,FDA 都了解到这些潜在挑战是可以克服的,试点不需要重新设计。
独立口译员试点
FDA 计划使用美国国务院的口译员在中国大陆进行独立口译员试点。FDA 计划在试点期间执行 34 至 119 次检查,具体数量将根据试点评估所需的精度水平确定。试点检查将包括批准前检查、监督和有因检查,以控制检查类型之间的差异。
FDA 在 2024 年 5 月报告称,口译试点项目很可能要到 2024 财年之后才会开始实施。FDA 报告称,正在优先为突击检查试点项目分配检查资源,并将继续评估中国不断变化的形势,以确定启动该试点项目的最合适时间。
海外办公室检查员空缺
海外办公室检查员的空缺有所增加,尤其是在中国。FDA 数据显示,2021 年 11 月,印度 6 个职位中有一个空缺,中国 9 个职位中有一个空缺。截至 2024 年 6 月,印度 7 个职位中有 4 个空缺,中国 9 个职位中有 7 个空缺。
FDA 认为在中国办公室招聘人员填补职位空缺所面临的挑战包括新冠疫情期间的限制以及对中国法律的担忧。FDA 表示由于新冠疫情控制,导致三名员工提前结束了在中国的工作。
识林
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多