生物制药水系统的特点与GMP管理
Part.01
引 言
Part.02
生物制品及制药用水概述
2.1
生物制品定义、分类及制备流程

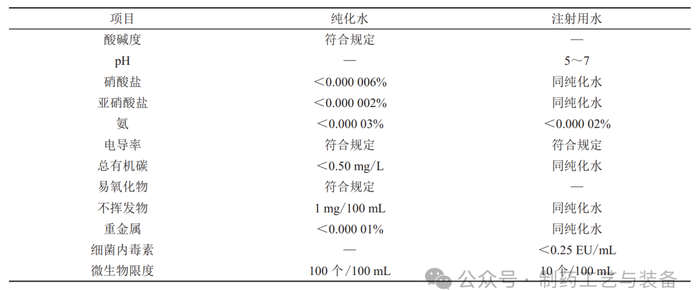
2.2
制药用水定义、分类及制备流程
在2015版《中华人民共和国药典》(以下简称为《药典》)中,制药用水主要是指饮用水、纯化水、注射用水和灭菌注射用水。在生物制药的生产过程中,主要涉及的是纯化水和注射用水的应用。根据《药典》中的定义,纯化水主要是通过蒸馏法、离子交换法、反渗透法等方法制备而成,而注射用水则是将纯化水经蒸馏后所得。
2.3
制药用水的质量标准及GMP要求
GMP是药品生产质量管理的基本准则,它包括四个基本要素,分别是硬件、软件、人员和工作现场。生物制药水系统作为生物制药生产过程中的直接影响系统,是生物制药硬件的重要组成部分,理应符合GMP的相关要求。
Part.03



Part.04
Part.05
参考文献
[1] 药品生产质量管理规范:国家卫生部第79号令[A].
仲伟成、梁毅
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多