ASD
和
LBF
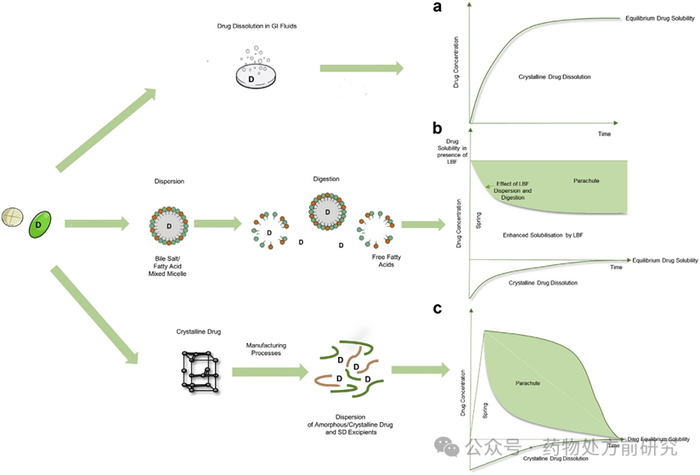
增溶及提高口服生物利用度的原理不同,具体如下图所示。普通制剂在给药后,晶体药物不断溶解,随着时间推移,溶解达到平衡。如果是
LBF
,药物溶解在脂质辅料中,在给药后,在胃肠道中胆盐的作用下会形成胶束、反胶束等等。而对于
ASD
,在制备的过程中,晶体样品会变成无定形,无定形样品具有更高的表观溶解度,但是热力学不稳定,在存储过程中或者在体内容易发生重结晶。
ASD
中的高分子材料可以抑制晶体药物的析出,使药物处于过饱和状态,从而提高生物利用度。
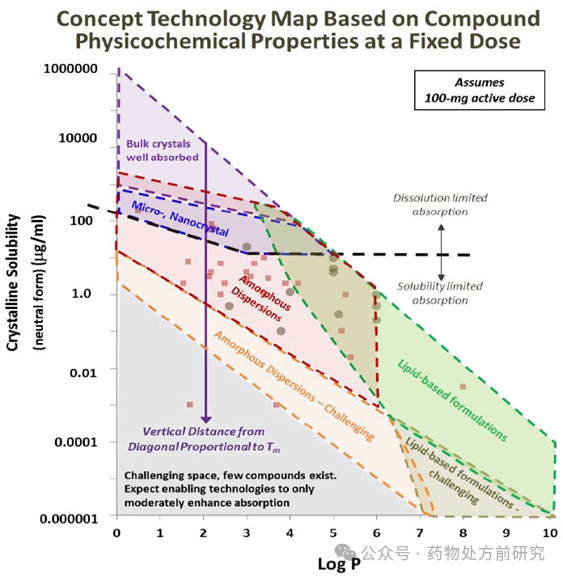
在难溶性药物开发时,一般会根据化合物的理化性质选择合适的增溶手段。比如化合物高熔点、高焓值,则比较适合开发固体分散体,以克服高晶格能。如果化合物亲脂性比较强,具有较高的脂质辅料溶解性,则可以考虑开发脂质制剂。也有些情况下,并不能通过化合物的性质直接选择制剂种类,需要考察不同类型制剂的效果。下图所示的是化合物溶解性
/
油水分配系数和制剂开发策略选择的关系图。需要注意的是,这只是经验指导,对于具体的化合物并不能直接套用,还是需要根据实际情况选择合适的制剂方法。
Harriet Bennett-Lenane
等人对上市药物进行了分析,研究了已上市
ASD
和
LBF
药物的理化性质差异。这对于候选化合物选择合适的制剂方法(
ASD vs LBF
)进行开发有重要的指导意义。
LBF
其实是一种相对比较成熟且历史悠久的制剂手段。自
20
世纪
40
年代以来,数十个
LBF
产品已成功获得批准上市。
LBF
早期商业化产品的例子包括
LFCS
(
lipid formulation classification system
)的
I
型(只含有油相)配方,例如
Drisdol®
。随着时间的推移,人们对自乳化药物递送系统
(self-emulsifying drug delivery system
,
SEDDS)
的兴趣不断增强。在
20
世纪
80
年代和
90
年代
,大量
LFCS III
型和
IV
型
LBF
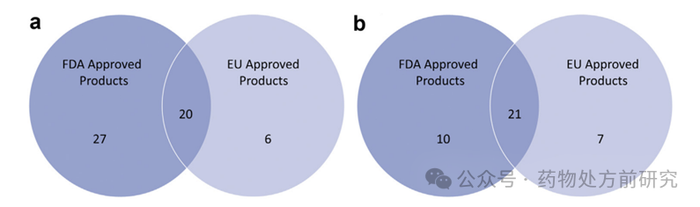
产品出现。统计发现,美国和欧盟的药品监管部门共批准了
67
个
LBF
商业化产品。如下图
a
所示,在美国获得授权的
LBF
产品数量
(47/67)
高于欧盟
(26/67)
。
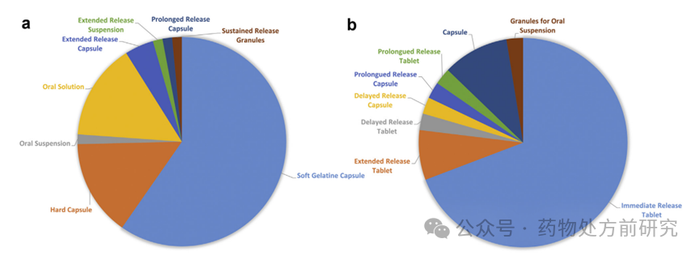
在少数情况下,同一药品有不止一种剂型,例如胶囊和口服溶液
(6/67
产品
)
。相比之下,几乎一半的产品
(28/67
种产品
)
获得了多剂量的许可。如下图
a
所示,软明胶胶囊是使用最多的
LBF
产品剂型
(40/67)
,其次是口服溶液
(10/67)
、硬胶囊
(10/67)
和口服混悬液
(1/67)
。还有
6
个产品是控释的,进一步证明了
LBF
药物递送的优势。它们分别是缓释胶囊
(3/67)
、缓释悬浮液
(1/67)
、缓释胶囊
(1/67)
和缓释颗粒
(1/67)
。显然,软明胶胶囊代表了更普遍的剂型,因为与硬胶囊相比,它们可以更安全地封装液体剂型。从数据看,虽然已经成功生产了悬浮液,但溶液制剂仍然是
LBF
商业化产品最常使用的。
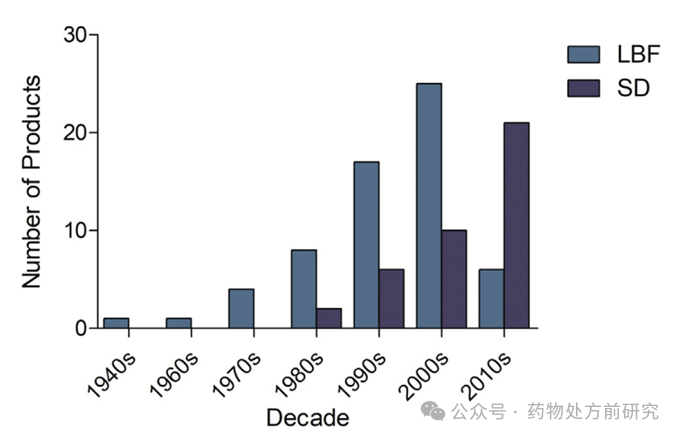
从上市的年份看,
2000
到
2009
年是
LBF
获批数量最多的时期
(37%)
,
20
世纪
90
年代和
21
世纪初上市的
LBF
药物占所有商业化
LBF
产品的
63%
。然而,自
2010
年以来,这种批准的激增趋势并没有持续下去,只有
9%
的
LBF
产品已经商业化。从图中也可以看出,
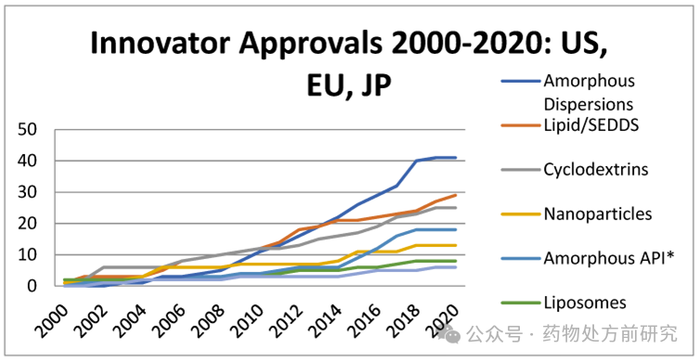
ASD
虽然起步较晚,但是近几十年来增长的趋势却很迅猛,在
2010s
就已经远超
LBF
。
ASD
相比于
LBF
是一种更为普适的增溶手段,因为无定形样品的溶解度一定高于对应晶体的溶解度,唯一不确定的是溶解度能够提高的程度。另外,
LBF
几乎均为溶液状态,对化合物的稳定性要求非常高;而
ASD
为固态,对化合物稳定性的要求相对较低。当然,对于临床前制剂,稳定性不是最重要的考虑因素。
最早的商业化
ASD
产品是
1982
年的
Cesamet®(Nabilone)
,一共有
39
个商业化
ASD
产品。与
LBF
相比,商业化的
ASD
产品数量相对较少,这是因为在
20
世纪
80
年代和
90
年代,
LBF
产品相对于
ASD
是一种更成熟的商业化制剂形式。例如,第一个
LBF
商业化产品比第一个
ASD
商业化产品
(Drisdol®
,
1941
年和
Cesamet®
,
1982
年
)
早
40
多年获得批准。从上市区域图中可以看出,近
50%
的
ASD
商业化产品在美国和欧盟市场都获得了授权。大多数
ASD
产品
(23/39)
与
LBF
类似,存在多剂量。在剂型方面,速释片是最常用的
(27/39)
。而口服混悬剂的胶囊
(4/39)
和颗粒剂
(1/39)
,以及控释片和胶囊,也以延长、延迟或延长释放的形式出现。
同时通过
LBF
和
ASD
技术已经商业化生产的药物有四个,分别是非诺贝特,洛匹那韦,利托那韦和尼莫地平。以洛匹那韦为例,它最初是与利托那韦在
Kaletra®
中作为
LBF
胶囊生产的,随后以具有更高剂量负荷能力的
ASD
片剂形式生产。由
LBF
改为
ASD
片剂,减少了服药负担,有助于提高药物的依从性和食物效应。利托那韦也在诺韦
®
中作为
ASD
和
LBF
商业化。利托那韦最初使用的是一种亚稳晶型,后面出现了一种热力学更稳定的晶型,其溶解度远低于亚稳晶型。新晶型的出现导致药物水溶性显著下降,生物利用度降低,因此,含有利托那韦的乙醇、表面活性剂水溶液填充胶囊被撤出市场。
1999
年,
AbbVie
申请批准一种
LBF
软明胶胶囊形式。在
2010
年,这种
LBF
形式被
ASD 100
毫克片剂取代,
ASD
片剂克服了冷藏的要求,提高了便利性。因此,在两个案例中
(
非诺贝特和尼莫地平
)
,
LBF
和
ASD
的选择主要基于商业策略,而对于洛匹那韦和利托那韦,最初推出了更成熟的
LBF
处方策略,但由于剂量负荷和稳定性的问题,最终被
ASD
取代。总的来说,观察到两种技术生产的药物只有相对较小的重叠,表明不同药物存在独特的药物特性,使候选药物更适合
ASD
递送而不是
LBF
递送,反之亦然。
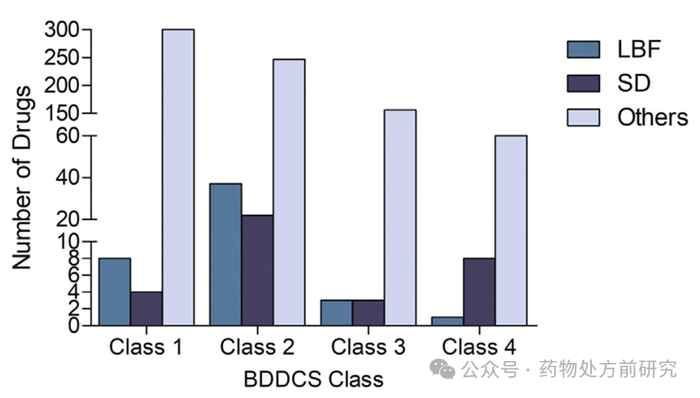
按
BDDCS
(
Biopharmaceutics Drug Disposition Classification System
)分级对
3
组药物(
LBF
、
ASD
和常规制剂)进行分组。正如预期的那样,商业化产品中
LBF(76%)
和
ASD(60%)
属于
BDDCS II
类的药物数量是最多的。第二高比例的
ASD
药物属于
BDDCS IV
类。相比之下,第二高比例的
LBF
药物是
BDDCS I
类,而
BDDCS I
类(高溶解、高渗透)化合物并不存在溶解性和渗透性的问题。这表明溶解度、渗透性并不一定是选择
LBF
的唯一考量。可能
LBF
的大规模生产能力已经建立,并且与其他更昂贵的技术平台
(
如
ASD)
相比,需要相对较低的技术投入。
将使用
LBF
和
ASD
技术商业化的药物的分子性质与未使用这两种技术商业化的药物的性质进行统计比较。统计发现化合物的
8
个属性有比较明显的差异,即
MW
、
logP
、
%U
、
logS
、
logD7.4
、
Ro5
、
Tm
和
clogP
。
下面将对这些不同的属性进行具体的分析和论述。
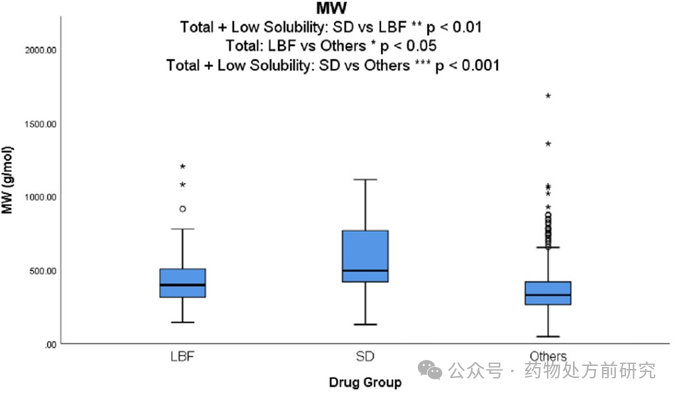
分子量(Molecular Weight,MW)
与通过传统制剂方法商业化的药物(平均
MW 354.6 g/mol
)相比,通过
LBF
和
ASD
方法商业化的药物显示出更大的
MW
。相比之下,
ASD
药物的平均分子量
(586.6 g/mol)
明显高于
LBF
药物
(448.2 g/mol)
,这表明尽管
LBF
和
ASD
都可以用于高
MW
药物的开发,
但
ASD
方法可能对于更高
MW
的药物更为适用。此外,当分析低溶解度数据集时,
LBF
药物和普通药物的
MW
差异就没有那么大了(
449.5 g/mol vs 394.6 g/mol
),但是
ASD
药物的平均
MW
却非常大(
618.4 g/mol
)。这说明
LBF
可能对高
MW
的
PWSD
(
poorly water soluble drugs
)的意义没有那么大,
ASD
则对高
MW
的难溶性药物适用性更强。
这些结果也反映了近几十年来药物开发管线中药物分子量增加的趋势。在过去的二十年中,高分子量药物进入市场的趋势是一致的,例如在
2016
年和
2017
年,
FDA
批准的新口服药物的平均分子量首次超过
500 g/mol
,
MW
的增大不仅仅是因为批准了一小部分非常高分子量的药物。从更长的时间跨度上来看,上市药物的
MW
确实是在增大的,如下图所示。
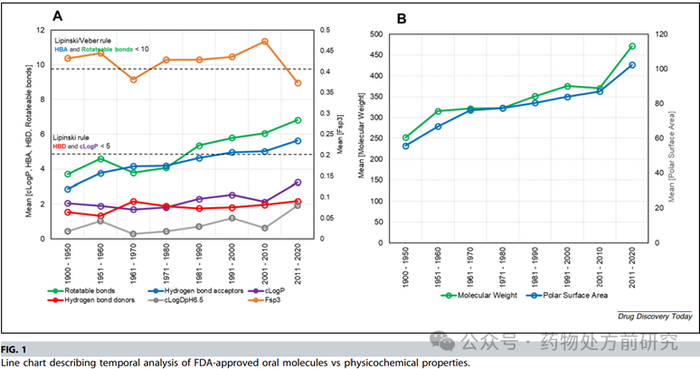
观察到上市药物MW不断增大的趋势与过去十年中ASD制剂数量增加的趋势一致。很明显,ASD为高分子量药物提供了更成功的商业记录。正如高分子量抗病毒药物所证明的那样,很多酶抑制剂药物以这种方式作为商业化的递送手段,例如Cokiera®,Epclusa®,Zelboraf®。这些结果也广泛支持了一般性的经验法则,即MW >300 g/mol的分子更容易转化为无定形状态。统计发现,只有2/37的MW < 300 g/mol的药物以ASD方式进行商业化生产。这可能是因为MW < 300 g/mol的化合物往往具有较高的溶解度,没有必要开发非常规的制剂。也有人认为,相对较高的MW增加了药物的玻璃态形成能力(glass forming ability,GFA)。从分析中可以看出,在更高的MW尺度上,MW为LBF和ASD之间潜在的商业化成功提供了一个区别属性,即ASD更适合分子量大的化合物,而LBF更适合分子量相对较小的化合物。
熔点 (Melting Point, Tm)
统计数据发现,
LBF
药物的平均熔点
Tm (160.8 ℃)
明显小于其他药物
(181.2 ℃)
。当分析低溶解度数据集时,这种显著性就不存在了,
LBF
药物的平均熔点略低于
ASD
药物和常规药物。当分析组间
Tm
的差异时,发现
ASD
组间的差异最小。
LBF
组和其他组的最低
Tm
值分别为
38 ℃
和
52 ℃
,但作为
ASD
生产的药物的最低
Tm
值大约是这两个
Tm
值的两倍
(80.5 ℃)
。前面已经提到,
ASD
药物的优势在于无定形对于晶体溶解度的优势,而晶体溶解需要克服晶格能。相同情况下,熔点越高,晶格能越大。这应该是
ASD
药物最低
Tm
值相对较高的原因。
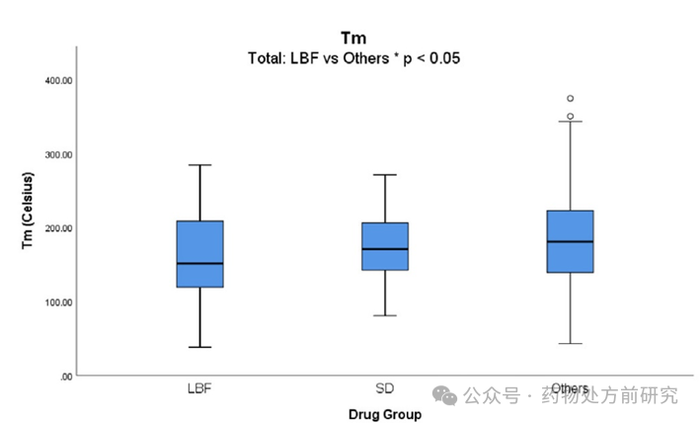
Tm
通常被认为是影响脂质辅料中溶解度的重要药物特性,作为打破分子间作用力和克服晶格能所需能量的指标。具有高晶格能和中等
logP
值
(>2)
的药物被称为“
brick dust
”。这一类化合物由于从固体形式解离的能力有限,通常在脂质中具有较差的溶解度,因此不是
LBF
的理想候选化合物。而低晶格能和高
logP
值的药物被称之为“
grease ball
”,这一类化合物通常在脂质辅料中具有较高的溶解度,是
LBF
的理想候选化合物。有文献报道,较低至中等
Tm
的化合物适合
LBF
,并且建议将
Tm< 150 ℃
作为选择
LBF
作为潜在可行制剂方法的基准。然而,统计发现上市药物中超过一半
(55%)
商业许可的
LBF
药物的熔点超过了通常推荐的
150 ℃
。然而,超过该值的药物的平均最大剂量显著降低
(Tm <150 ℃
的药物为
148.62 mg
,
Tm >150 ℃
的药物为
81.48 mg)
。
Tm
可能影响药物在脂质辅料中的溶解度,但需要的溶解度和目标剂量是相关的。对于低剂量药物,
Tm
超过
150 ℃
可能不是限制其使用
LBF
的考量因素。
亲脂性 (logP, clogP, logD7.4)
在过去的
15-20
年里,亲脂性仍然是候选药物开发的一个重要特性,部分原因是新药靶点的亲脂性分子要求。亲脂性被认为与
MW
相关,但它似乎比其他药物性质随时间的变化更小一些。
2016
年对当时获得专利的
1620
个分子的统计分析发现,大约
50%
的分子显示平均
logP ≥ 4
。因此,
Leeson
和
Springthorpe
甚至提出亲脂性是最重要的药物特性,高亲脂性可能导致多靶点结合和潜在毒理学的风险增加。
正如预期的那样,
LBF
商业化药物的
logP
、
clogP
和
logD7.4
值明显高于其他数据集中的药物分子。高亲脂性有望促进脂质载体中足够的药物装载能力。文献报道,具有高亲脂性和相对低
Tm
的“
grease ball
”药物分子是
LBF
的良好候选者,而
LBF
促进淋巴吸收的能力对于高亲脂性药物是最优的
(logP > 5)
。总的来说,由于观察到的平均
logP
值为
4.7
,因此,
logP
值约为
4-5
的药物是商业化
LBF
的良好候选者。
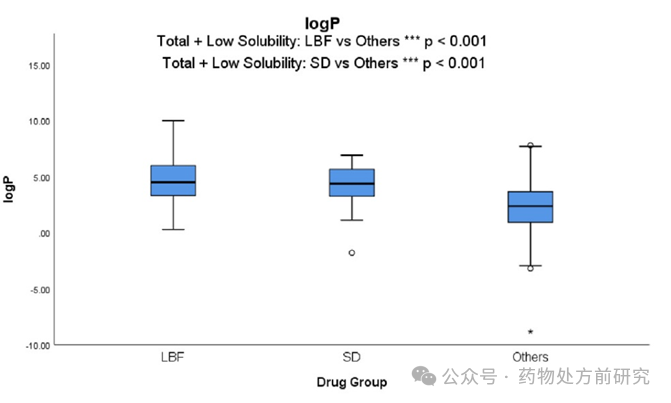
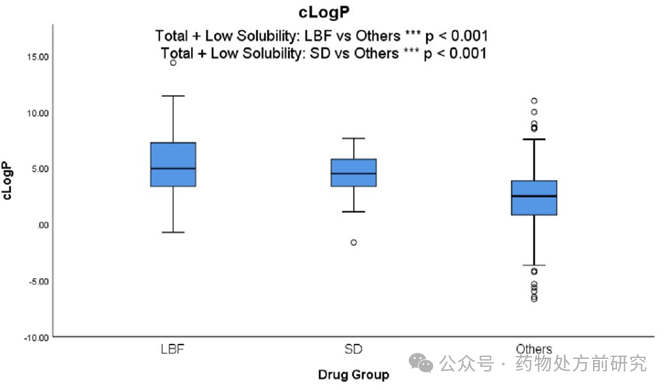
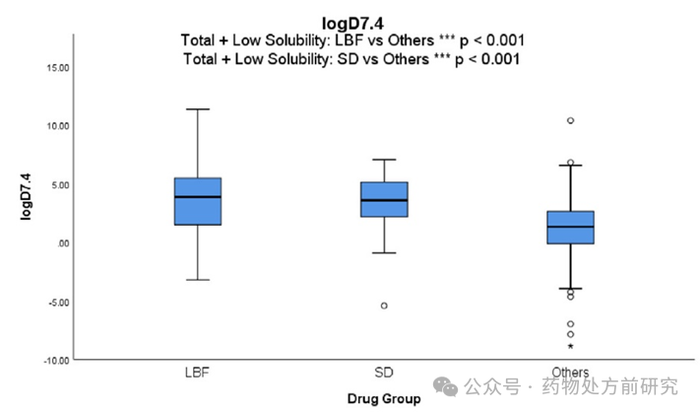
统计结果表明,
ASD
药物的亲脂性明显高于常规药物,但
LBF
和
ASD
药物却不能从这个参数中进行很好的区分(
4.84 vs 4.60
)。例如,早期对
Kaletra®
和
Norvir®
含有高度亲脂性药物
(clogP 4.7)
的案例研究表明,这些药物可以成功地作为
LBF
和
ASD
生产。在这些情况下,尽管化合物具有高亲脂性,但
ASD
形式最终在商业化上更有利。制剂方法的选择,不仅仅与化合物的性质有关,同时还与商业化的考量有关,如成本,长期稳定性等等。
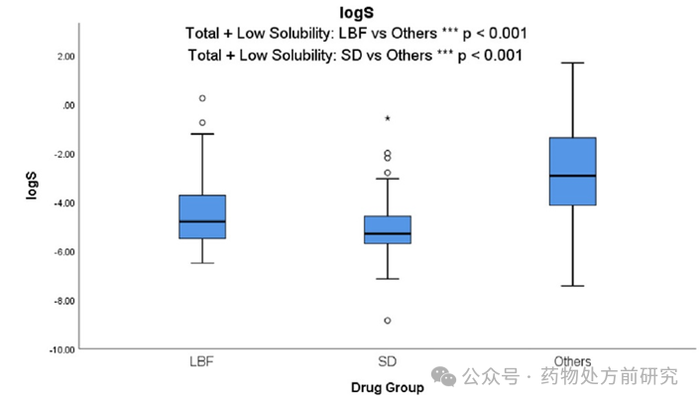
水溶性(logS)
LBF
和
ASD
多数情况下要解决的就是难溶性药物的溶解性问题,因此,开发
LBF
和
ASD
的药物通常具有差的水溶性。正如预期的那样,在药物的总数据集中,
LBF
和
ASD
药物的水溶性
(
以
log
表示
)
都明显低于其他药物。当从数据集中排除高溶解度药物并仅使用低溶解度药物重新分析时,意义仍然存在。这表明,即使在
PWSD
类别中,
LBF
和
ASD
技术也提供了促进作为口服药物产品的商业化开发的机会。
在将亲脂性和亲水性联系起来时,
Bergstrom
等人先前提出,
logP > 3
是化合物与水相溶剂相互作用减少的一个指标。商业化
LBF
的平均
logP
值
(4.66)
和
ASD(4.16)
都落在这个区间。这样的结果是可以预期的,因为这两种制剂技术都提出了一种潜在的“低溶解度挑战”药物递送解决方案。
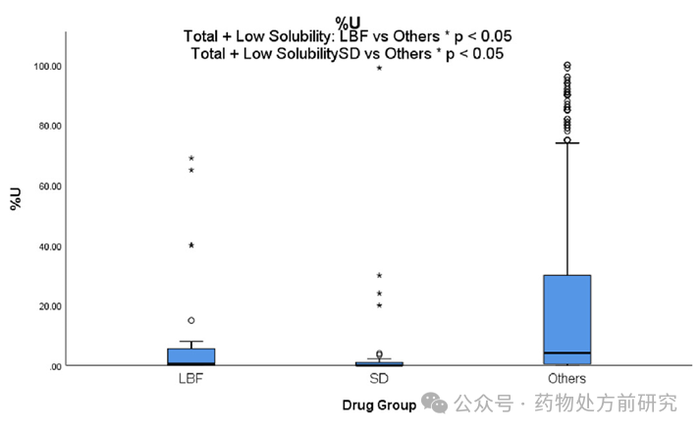
化合物随尿液排出百分比 (%U)
尿液中药物排泄的百分比(
Percentage Excreted Unchanged in Urine
,
%U
)也可以区分适合
LBF
和
ASD
的药物,但不能区分两种给药技术。与其他数据集相比,
LBF
和
ASD
药物从尿液中排泄的百分比明显较低。这并不意外,因为在尿液中排泄的药物通常是高度水溶性的,而
PWSD
需要代谢成代谢物,这些代谢物可能极性更强,才能更容易通过尿液排泄。
然而,一系列因素可能会影响这一特性的预测能力,包括口服给药需要生物利用度因子,以及某些药物或活性代谢物可能以不变的方式以胆汁而非尿液排出。这一性质表明
ASD
和
LBF
药物的亲水性不如其他药物,与前面的结论一致,它们具有较高的亲脂性和较低的水溶性。
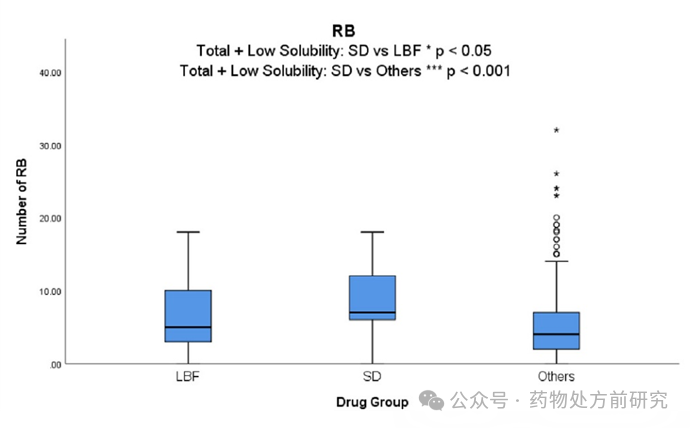
可旋转键数 (Rotatable Bond Count,RB)
ASD
商业化产品的平均可旋转键数
RB
(
8.8
)明显高于
LBF
(
6.6
)和其他产品(
5.2
)。再一次反映了候选药物的当前趋势,包括
MW
和
RB
数在内的物理性质随着时间的推移而增加。这一发现补充了先前的统计结果,即具有高无定形稳定性的化合物含有更多的
RB
。
Baird
等人认为,较高的
RB
和分子柔性降低了药物结晶的可能性,并证明高
MW
和高
RB
都表明较高的
GFA
和较低的结晶倾向
(
即
III
类
GFA)
。另外,
Kuentz
等人认为,
RB
的数量可以衡量分子的柔性,对药物的无定形溶解度优势有积极影响。相对较高的
RB(
例如
5-10)
表明该化合物适合
ASD
方法,并且在机制层面上,这很可能反映了具有良好玻璃态形成能力的药物显示出长时间维持过饱和度的能力。相对于较差的玻璃态形成药物,过饱和溶液中发生重结晶析出的风险更大。
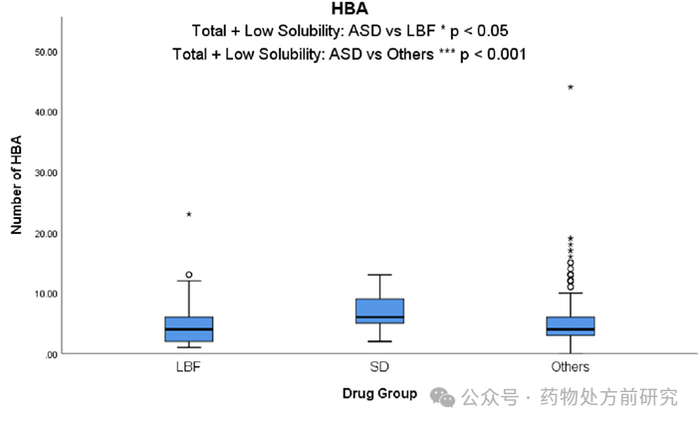
氢键受体 (Hydrogen Bond Acceptors,HBA)
HBA
数被观察到是区分
ASD
商业化药物与
LBF
和其他药物的适用性的一个属性,
ASD
药物的
HBA
平均值明显更高
(6.87)
。
HBA
数的重要性反映在,以
HBA
值大于
10
作为标准,
ASD
药物
(24%)
超过
LBF
药物
(10%)
的
2
倍。此外,当仅比较低溶解度药物时,
ASD
与
LBF
和其他药物差异的显著性被加强。氢键相互作用增加了非晶态的稳定性和刚性,这使得晶体形成越来越困难。
在非晶溶解度优势预测中,
HBA
的数量是继分子量之后最重要的描述符。此外,原料药和聚合物辅料之间的氢键是帮助聚合物抑制药物结晶和促进非晶稳定性的重要特征。两者之间的氢键在固体分散体中表现出较低的结晶倾向和最高的抗结晶性。
ASD
使用聚合物载体,或者单独使用,或者与其他聚合物或表面活性剂一起使用。聚合物被发现是商业化
ASD
中最广泛使用的辅料,无论是晶体还是非晶态
ASD
。
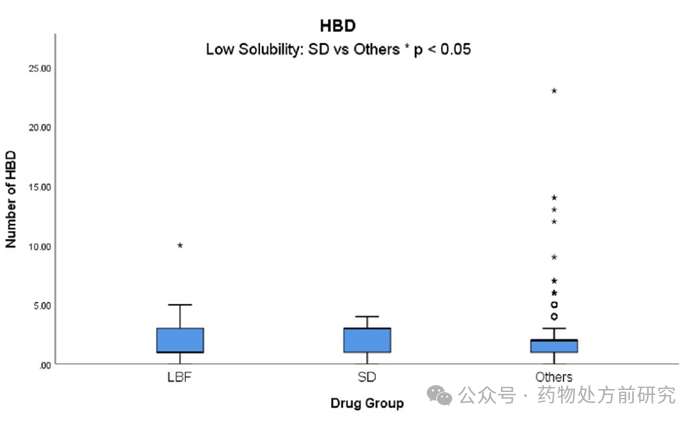
氢键供体 (Hydrogen Bond Donors,HBD)
HBD
和
HBA
都是
Lipinski Rule-of-5
中的描述符。
HBD
和
HBA
对非晶态稳定性,聚合物与药物之间的氢键相互作用都很重要。然而,在这种情况下,对整个数据集的分析中,
HBD
并没有被发现是
LBF
、
ASD
或其他药物之间的区别属性。然而,当仅分析低溶解度药物时,
ASD
和其他药物
HBD
之间存在显著差异。
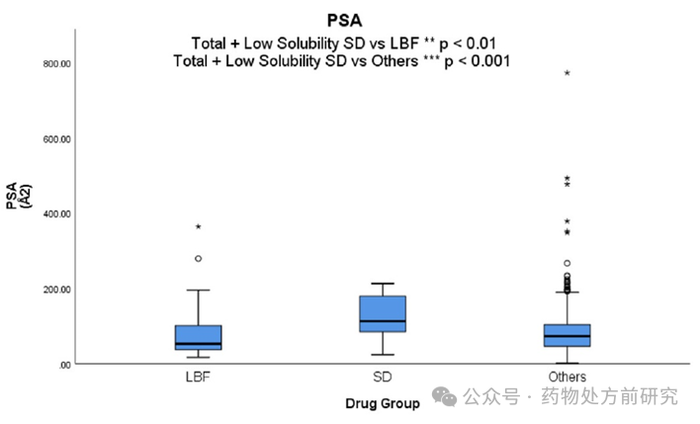
极性表面积 (Polar Surface Area,PSA)
极性表面积是常用于药物化学的一个参数,其定义为化合物内极性原子的总表面积,多为氧原子及氮原子,也包括与其相连的氢原子。文献报道,根据他们在肠道
Caco-2
细胞中的结果,
PSA
为
60 Å2
或更低的药物被完全吸收,而
PSA
为
140 Å2
以上的药物则不能。
ASD
药物数据集的
PSA
平均值
(125.92 Å2)
明显高于
LBF
药物
(79.68 Å2)
和其他药物
(81.48 Å2)
,这两个数据集在仅比较低溶解度药物时仍具有显著性。相比之下,药物的发展趋势表明,多年来药物的平均
PSA
越来越大。
PSA
的增长趋势和
MW
的增长趋势基本是一致的。然而,需要注意的是,相关性并不意味着因果关系,因为在这种情况下,更高
PSA
的新候选药物的日益增多以及
ASD
技术的日益广泛使用可能代表两种情况下的独立趋势,或者反映两者的互补性。
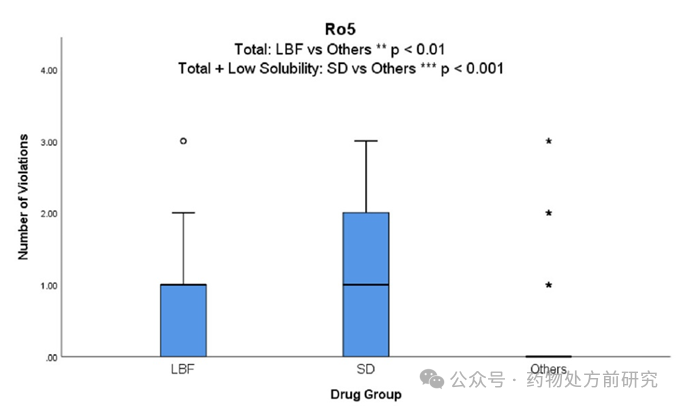
Lipinski Rule-of-5违例 (Ro5)
2000
年,
Lipinski
等人介绍了关于
“
类药性(
drug-like
)
”
分子描述符的
5
规则(
rule of 5
,
Ro5
),该规则为基于渗透性和溶解度评估不良吸收提供了可能。
Ro5
标准定义了四个分子描述符:分子量
MW≤500
,油水分配系数
LogP≤5
,氢键供体数
(HBD)≤5
,氢键受体数
(HBA)≤10
。
观察到药物组别与
Ro5
违例发生率之间存在显著关联。一般情况下,口服药物有不超过一个违反
Ro5
的描述符。
30%
的
ASD
药物和
18%
的
LBF
商业化药物有
>1
违规,而其他药物仅为
6%
。可以预见的是,随着药物研发的不断发展,会有更多的候选化合物不满足
Ro5
。但是新的药物递送技术为这些药物的开发提供了可能。

































评论
加载更多