首先,我们了解下转甲状腺素蛋白淀粉样变性多发性神经病的发病机制以及
TTR
靶点;
转甲状腺素蛋白淀粉样变性多发性神经病
[1]
(
transthyretin amyloid polyneuropathy
,
ATTR-PN
)又称转甲状腺素蛋白相关家族性淀粉样变性多发性神经病(
transthyretin familial amyloid polyneuropathy
,
TTR-FAP
),是由编码转甲状腺素蛋白的
TTR
基因致病变异导致的一种罕见的常染色体显性遗传性、以周围神经损害为主的多系统疾病,常见的临床表现为中枢神经系统症状和周围神经病,中枢神经系统症状常表现为:癫痫发作、共济失调、头痛;周围神经病的症状常表现为:腹泻、便秘、腹泻便秘交替、胃瘫及进食后呕吐等等;
TTR
是一种机体内部的重要蛋白,由两个二聚体组合为四聚体,而二聚体又是由两个单体组成,单体又是由
127
个氨基酸组成。根据文献报道,
TTR
蛋白主要在肝脏合成,也有少量为脑室脉络膜细胞及视网膜色素上皮细胞产生,其功能是结合并转运血浆中的甲状腺素和维生素
A
(视黄醇);而
TTR
基因的突变可导致原本稳定的四聚体在细胞外分解为不稳定的单体,单体又被进一步的错误折叠,致使多种聚集形态的淀粉状蛋白沉积于周围神经、交感神经等诸多位置。由此可见,转甲状腺素蛋白淀粉样变性多发性神经病发病机制主要是由
TTR
基因出现突变导致,通过
NCBI
查询,
TTR
基因主要存在于肝脏中,
ASO
主要是通过与
TTR mRNA
进行结合,使
TTR mRNA
基因沉默,进而减少
TTR
蛋白的产生,因此
ASO
药物的靶点主要在肝脏中。
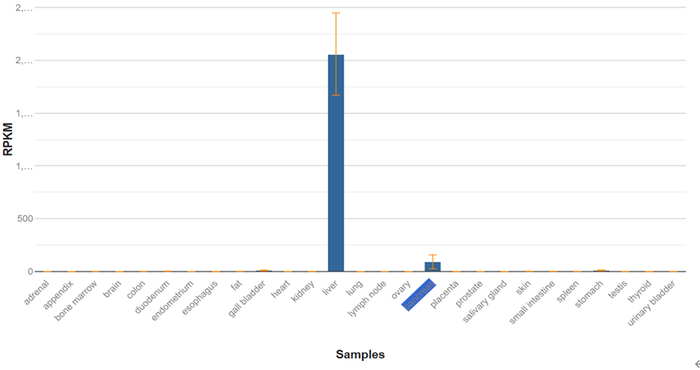
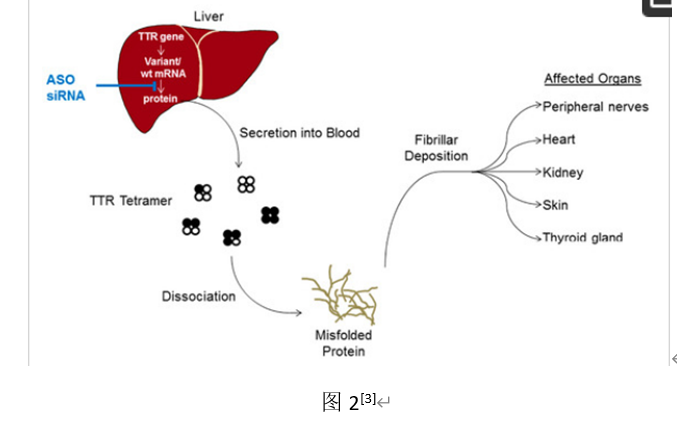
由上述机制我们知道,
TTR
基因主要存在于肝脏中,那么毫无疑问采用
GalNAc
递送系统后,效果肯定优于未采用
GalNAc
递送系统;那么,对于相同的序列、相同的修饰、相同的靶点,采用
GalNAc
递送系统和未采用
GalNAc
递送系统的药物其作用究竟相差多少倍呢?
根据
Thazha P[4]
文献报道,对比了两种药物,一种对药物进行
GalNAc
偶联,另一种未采用
GalNAc
偶联,均是采用
MOE
修饰,具体如下;
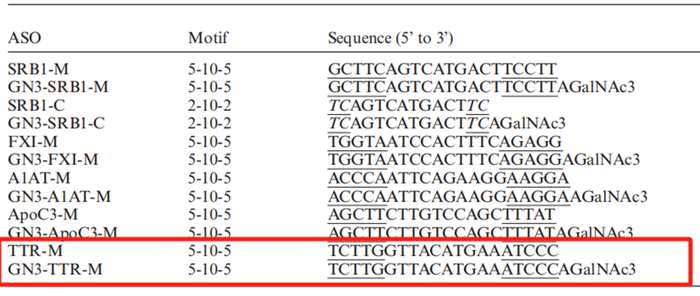
结果显示,通过对人转基因小鼠(
hTTR
)每周皮下注射
TTR-M
(
6
、
20
和
60mg/kg
)和
GN3-TTR-M
(
0.6
、
2
、
6
和
20mg/kg
),持续
3
周,最后一次注射
72h
后处死,分析其肝脏中
hTTR mRNA
的减少情况和小鼠血浆中
hTTR
蛋白的减少情况,与
TTR-M
相比,
GN3-TTR-M
在降低肝脏中
hTTR mRNA
和小鼠血浆中
hTTR
蛋白的效力提高了
10
倍;
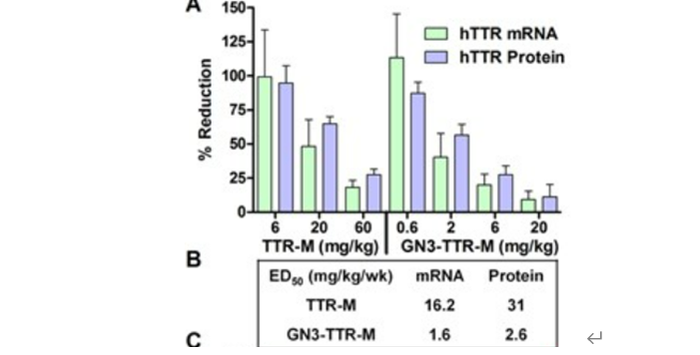
于此同时,
Thazha P
还对其持续时间进行了比较,结果显示给转基因小鼠注射单剂量
TTR-M
(
100 mg/kg
)或
GN3-TTR-M
(
13.5 mg/kg
),每周尾部取血监测血浆
TTR
蛋白的减少情况,持续约
7
周。对于用
TTR-M
治疗的小鼠,血浆
hTTR
蛋白在第
39
天恢复到基线水平,而用
GN3-TTR-M
治疗的小鼠在注射后
39
天仍然保持约
30%
的血浆
hTTR
蛋白水平抑制。
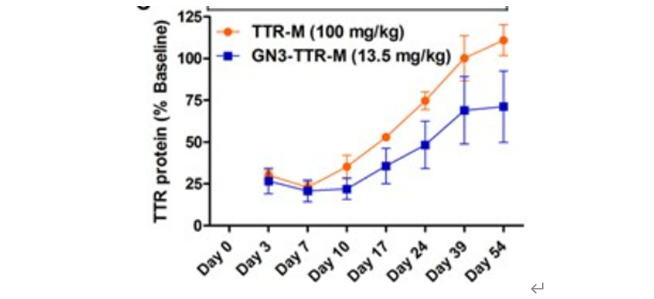
由此可以看出,
采用
GalNAc
偶联之后,不但可以提高效力,还可以延长其作用时间,根据文献得知,偶联
GalNAc
的药物主要是进入肝脏的实质细胞,而未偶联
GalNAc
的药物主要是通过内皮细胞吸收(约占
56%
),剩下
39.6%
被实质细胞吸收,而肝脏是有
80%
实质细胞组成,目前大多数具有治疗意义的基因在肝脏的实质细胞中表达,这也是导致偶联
GalNAc
的药物效力明显强于未偶联药物的原因之一。
接下来,我们来分析下,为什么
Eplontersen
采用
PO/PS
混合修饰,而
Inotersen
主要全部采用
PS
修饰?
我们都知道,寡核苷酸的磷酸二酯键被硫代磷酸(
PS
)键修饰,即核苷酸间磷酸基的一个非桥接氧原子被硫取代,已经被广泛应用于
RNA
靶向药物的开发。
PS
核糖骨架是一种非常有效的修饰,具有核酸酶抗性和促进与血浆蛋白质结合的双重作用,从而减少肾脏清除率,增加药物的体内循环时间、改善药物的药代动力学,延长药物的半衰期。虽然
PS
修饰有很多优点,但并不是完全没有缺点的,
PS
修饰骨架可引起免疫活性,高浓度
PS
骨架修饰可以降低靶标的亲和力,使机体产生炎症反应。
那么在新一代产品
Eplontersen
为什么要将全
PS
修饰变为
PO/PS
混合修饰呢?通过查询
Eplontersen
专利
[5]
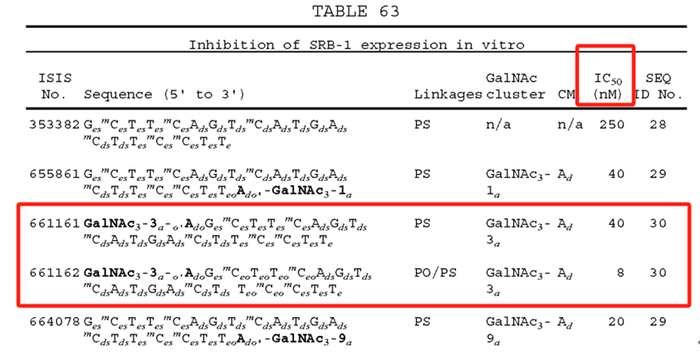
我们可以发现,针对
SRB-1
靶点的两种药物
ISIS No.661161
和
ISIS No.661162
,其中
ISIS No.661161
采用的是全
PS
修饰,
ISIS No.661162
采用的是
PO/PS
混合修饰,修饰位点与
Eplontersen
相似;通过体外细胞培养测定
IC50
我们可以得知,采用全
PS
修饰的
ISIS No.661161
的
IC50
为
40nM
,采用
PO/PS
修饰的
ISIS No.661162
的
IC50
为
8nM
,两者相差
5
倍;也就是说,与全
PS
修饰相比,采用
PO/PS
混合修饰的方式有可能会提高其作用效力。另外通过文献
[9]
查询,采用
PO/PS
混合修饰的寡核苷酸不但与互补靶点的亲和性增加,还可以降低毒副作用。
我们都知道
Inotersen
和
Eplontersen
主要是通过与目标
mRNA
结合,激活
RNase H
切割导致
mRNA
降解,进一步导致目标蛋白的减少。那么
Eplontersen
和
Inotersen
在体内是如何分布和代谢的呢
?
根据
Eplontersen
的说明书我们得知,
Eplontersen
皮下给药后,在
2h
达到了最大血浆浓度,主要分布于肝和肾;根据
Eplontersen
的审评报告
[6]
得知,
Eplontersen
在血浆中
99%
为全长寡核苷酸,未检测到较短的寡核苷酸代谢物(一个或多个核苷酸缺失的寡核苷酸);但药物进入肝脏后,首先在
GalNAc
上酰胺键进行水解,去除
GalNAc
的三个糖基,接下来进一步在寡核苷酸与
GalNAc
相连的磷酸二脂键的水解,整个过程非常块,在
1h
内,也很少有人能够提取出完整的全长寡核苷酸药物,在
4h
就完全检测不出全长寡核苷酸药物,在
8h~72h
进一步水解,形成寡核苷酸药物。多次注射后,药物的半衰期为
3~4
周
;
根据
Inotersen
说明书,我们得知,
Inotersen
皮下注射后,在
2h~4h
达到了最大血浆浓度,药物进入血浆迅速被广泛分布在各组织中,在肾脏和肝脏中浓度最高,在
2h
内,血浆约大于
73%
的全长寡核苷酸药物,
24h
后,大于
69%
的药物在肝脏和肾脏中检测到,各种
3'
代谢产物产生,比如
8
个碱基或更长的序列,约占小于
10%
;在肾脏中检测出
5'
代谢产物,在尿液和粪便中含有
5-8
个碱基的
3'
缺失的代谢产物,很少有母药存在。
Inotersen
的最终消除半衰期为
32.3
天。
根据两者的体内分布和代谢我们可以得知,
Inotersen
进入体内后,很快被代谢,而
Eplontersen
在血浆中几乎不被代谢,进入肝脏后,被迅速代谢,这导致药物的半衰期有很大的差异,最终也会影响药物的作用持久时间。
综上所述,升级版的
Eplontersen
的剂量为
Inotersen
的
25
倍,主要有以下因素,第一:
GalNAc
偶联,进一步导致以下作用:
①
使药物在血浆中更加稳定,不被代谢,根据文献报道,偶联
GalNAc
导致空间位阻效应,造成药物在血浆中更加稳定;
②
使药物更加精准的靶向肝细胞,实质细胞而不是内皮细胞,实质细胞为靶基因的场所,使得药物更加精准到达目的地;
③
相对于
Inotersen
,
Eplontersen
在肝脏
72h
后,代谢释放成
ASO
,随后才进一步被水解,这也是导致
Eplontersen
作用时间长于
Inotersen
的原因之一。第二:采用
PS/PO
修饰药物活性强于全
PS
修饰的药物;并且可以通过降低其核酸酶的稳定性来调节寡核苷酸的耐久性,进而降低毒性。
以上是基于当前认知水平进行分析总结,如有错误,欢迎大家留言指正
参考文献
[1]TTR基因Arg54Thr突变致家族性淀样多发性周围神经病一家系分析
[2]https://www.ncbi.nlm.nih.gov/gene/7276
[3]Klinik für Transplantationsmedizin Therapeutic Oligonucleotides Targeting Liver Disease: TTR Amyloidosis Molecules 2015, 20(10), 17944-17975; https://doi.org/10.3390/molecules201017944
[4]Thazha P Targeted delivery of antisense oligonucleotides to hepatocytes using triantennary N-acetyl galactosamine improves potency 10-fold in mice Nucleic Acids Research, 2014, Vol. 42, No. 13
[5]US10683499B2
[6] https://www.accessdata.fda.gov/drugsatfda_docs/nda/2024/217388Orig1s000IntegratedR.pdf
[7]Targeted Delivery of Antisense Oligonucleotides to Hepatocytes Using Tri-antennary N-Acetyl Galactosamine Improves Potency 10-fold in Mice Supplementary Material
[8]https://www.accessdata.fda.gov/drugsatfda_docs/nda/2018/211172Orig1s000PharmR.pdf
[9]Mixed-Backbone oligonucleotides as second-generation antisense agents with reduced phosphorothioate-related side effects Volume 8, Issue 22, 17 November 1998, Pages 3269-3274 https://doi.org/10.1016/S0960-894X(98)00591-





















评论
加载更多