“科默”之恋的反转再反转 后面还有多少惊喜
 图片来源:科伦博泰公告
图片来源:科伦博泰公告
合作项目的推进,为降温的“科默”之恋带来一丝反转。
默沙东的小心思
科伦博泰2022年与默沙东先后订立三项许可及合作协议,开发其用于癌症治疗的多达9项ADC资产,其中一项开发多达7项临床前ADC资产的合作,是截至当时中国药企获得最大的生物制药对外许可交易,一时间,让“科默”之恋成为药圈内的一段佳话。
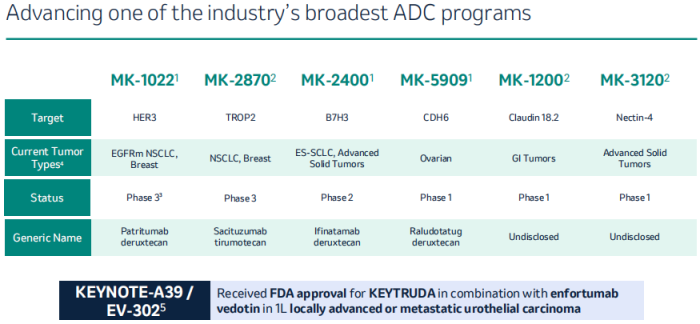
日本ADC插足。与默沙东退货时间高度重合的是,2023年10月,默沙东与第一三共达成一项220亿美元的合作,而合作内容正是3款ADC药物,分别为Patritumab(MK-1022)、Ifinatamab(MK-2400)和Raludotatug(MK-5909)。
默沙东在布局ADC领域时非常看中科伦博泰,与其达成的9项ADC资产合作中的7项为临床前ADC资产,采取一次性打包合作方式,而就在合作协议达成后的不久,默沙东就搭线了第一三共,且退货了科伦博泰的2项目临床前ADC资产,总有点被第三者插足的味道。
值得注意的是,默沙东为了7项临床前ADC资产,一次支付科伦博泰1.75亿美元不可退还首付款,而默沙东宁可亏损部分首付款,也要退货,到底是人傻钱多,还是另有所图。
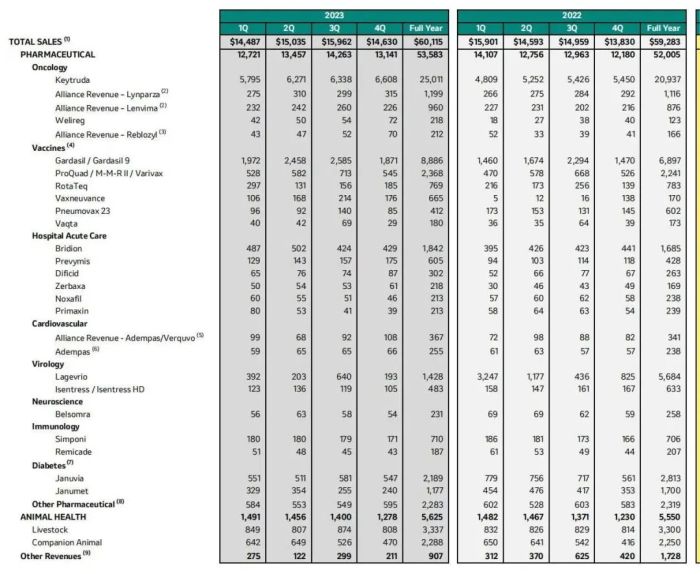
默沙东的小心思。默沙东人用药品虽涉及肿瘤、疫苗、心血管、神经学、糖尿病等多个领域,但肿瘤领域为其业绩最重要支柱,2023年,其肿瘤产品收入为276亿美元,占人用药品总收入(535.83亿美元)的51.51%。
值得注意的是,虽然5款肿瘤产品收入较2022年均有所增长,但一枝独秀的格局至今未能改变,Keytruda在2023年收入250.11亿美元,占肿瘤产品总收入之比由2022年的90.18%微增至2023年的90.62%。
 图片来源:默沙东2023年Q4财报
图片来源:默沙东2023年Q4财报
 图片来源:默沙东官网
图片来源:默沙东官网
两强争艳,谁更胜一筹

图片来源:科伦博泰招股书
 图片来源:科伦博泰招股书
图片来源:科伦博泰招股书
SKB264用于治疗既往至少接受2种系统治疗的不可切除局部晚期或转移性三阴性乳腺癌(TNBC)成人患者的上市申请,已在2023年12月获国家药监局受理,此前被国家药监局授予突破性疗法认定,且被纳入优先评审程序。
当然,并不能仅以自家之长与他家之短比较,毕竟第一三共已有ADC药物获批上市,且在其他多个靶点ADC药物研发进展上也领先于科伦博泰。
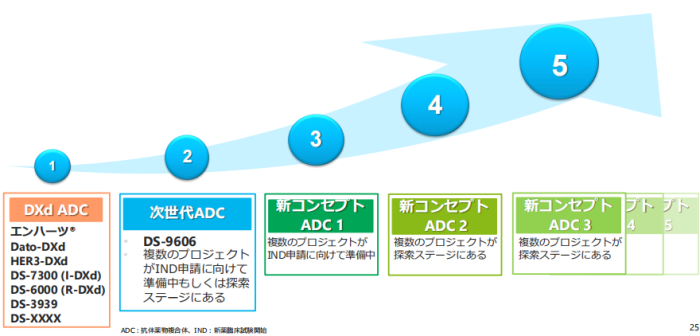
管线灵活性更强。第一三共一直专注于ADC药物研发,其现有管线及未来发展战略上,都集中在ADC领域。
 图片来源:第一三共官网
图片来源:第一三共官网
 图片来源:科伦博泰2023半年报
图片来源:科伦博泰2023半年报
小结
新药研发反转的故事比比皆是,而科伦博泰在走向国际化ADC的道路上的一次反转,让其再次成为ADC领域的焦点,临床前ADC资产是否有更多的正向反转,值得期待。
相关药企官网、公告及财报
撰稿人 | 赵言午 药渡Daily
责任编辑 | 邵丽竹
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多