工艺验证“连续三批”的含义?
Q
工艺验证要求至少进行连续三批次的工艺验证,如何正确理解“连续三批”的含义?
答:连续三批一般是指批号连续的三批,在一段时间内完成,以避免人员、气温等因素造成差异。
三批次要求
-
NMPA GMP 确认与验证附录
第六章 工艺验证
第二十四条 企业应当根据质量风险管理原则确定工艺验证批次数和取样计划,以获得充分的数据来评价工艺和产品质量。
企业通常应当 至少进行连续三批成功的工艺验证。 对产品生命周期中后续商业生产批次获得的信息和数据,进行持续的工艺确认。 第八章 清洁验证
第四十条 清洁验证的次数应当根据风险评估确定,通常应当至少进行连续三次。
-
NMPA GMP指南
-
大部分取样量内容描述为 :三倍单位剂量,每个点取样三份… -
US FDA工艺验 证也分为三阶段…
-
CFDI关于三批次的问答





连续是相对状态,也非绝对状态。
应参考ICH Q12生命周期管理理念,工艺验证大家都比较熟悉,一般分为“三个阶段”。如下图所示:
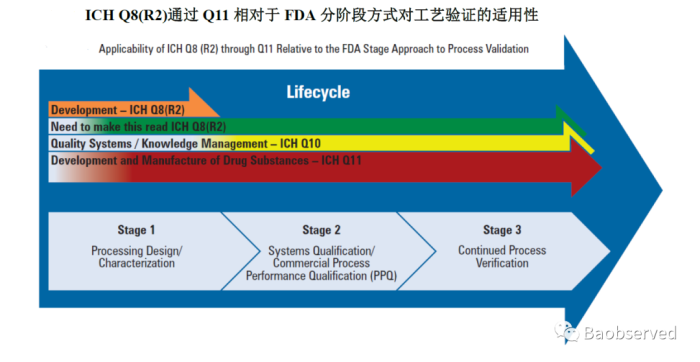
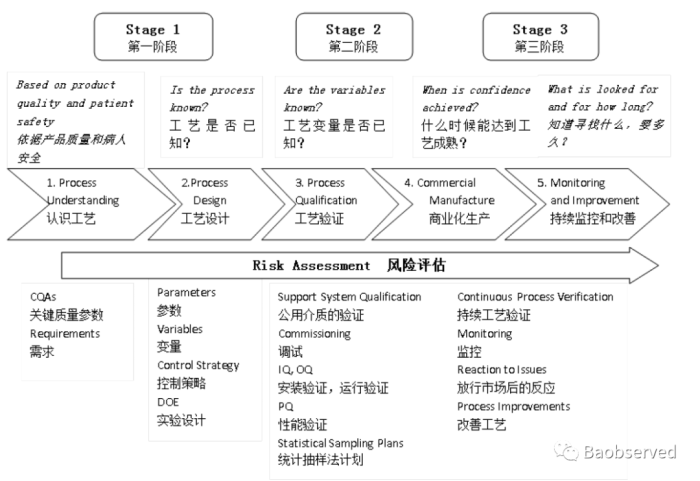
第一阶段:PD,工艺设计/描述 第二阶段:PPQ,工艺验证(商业化工艺性能确认) 第三阶段:CPV,持续工艺确证 |
在第一阶段,主要是依据产品开发建立的QTPP(产品质量概况),确认CQA(关键质量属性),探索CPP(关键工艺参数),逐步明确生产工艺,开展不同程度的试产,直至明确参数范围、工艺与设备匹配性等。
第一阶段:PD,工艺设计/描述 第二阶段:PPQ,工艺验证(商业化工艺性能确认) 第三阶段:CPV,持续工艺确证 |
做为第二阶段的工艺验证主要为了证明工艺能按照方案执行并满足预设的可接受标准,具备商业化生产相对重现性,一般都采取连续的三批次,用于临床研究、注册申报、变更等。
第一阶段:PD,工艺设计/描述 第二阶段:PPQ,工艺验证(商业化工艺性能确认) 第三阶段:CPV,持续工艺确证 |
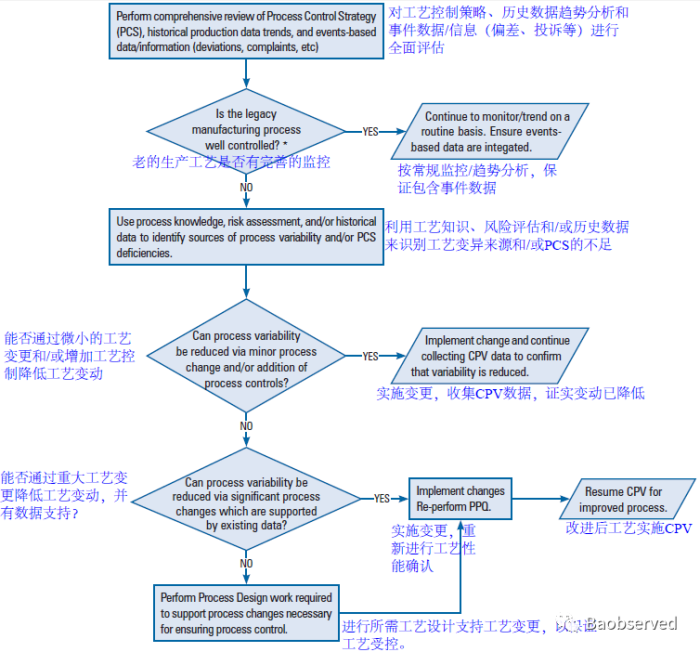
持续工艺确证的开展策略会根据产品特性、剂型、预定用途等大不相同,需依据风险制定与其相适应的监测计划。未来全部剂型批记录电子化后,关键数据也需会动态形成趋势曲线...质量源于设计的理念才会根深蒂固,质量源于生产的过程才会更加关键...连续制造,实时放行,也许不再遥远...相关计划可参考PDA TR-60,如下所示:
撰稿人 | Mr.bao Baobserved
责任编辑 | 邵丽竹
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多