策略盘点:2023年FDA批准口服制剂的药学变更研究
2023年FDA药物评估和研究中心(CDER)共批准新药55款,其中小分子药物32款,从获批小分子的给药途径看,吸入和眼部给药3款,静脉及皮下注射5款,而口服给药产品则有24款,占比达到75%。从适应症来看,这些小分子药物的适应症主要分布于肿瘤、免疫、心血管疾病等需要长期用药的领域,口服给药途径由于便捷性、顺应性、无需院内护理等优势,成为其首选给药途径。但相对于注射剂,口服制剂开发中的药学变更风险评估、桥接策略制定、以及相应的研究都更为复杂,将直接影响产品的推进速度和风险控制。
本文梳理了2023年FDA批准口服制剂的药学变更内容,其中高频发生的有剂型、生产场地、处方工艺等方面的变更;对多个项目的变更研究内容进行了剖析,针对相似变更情形下的不同变更策略进行了对比,力求窥见成功上市产品背后的药学变更策略制定经验。
对2023年获得FDA批准的创新小分子整体情况进行描述
2023年FDA药物评估和研究中心(CDER)共批准新药55款,其中化学小分子药物有32款,占据了50%以上。而其中24款为口服给药制剂,3款为静脉给药,2款为皮下给药,鼻腔和眼部给药共3款,具体如表1所示。
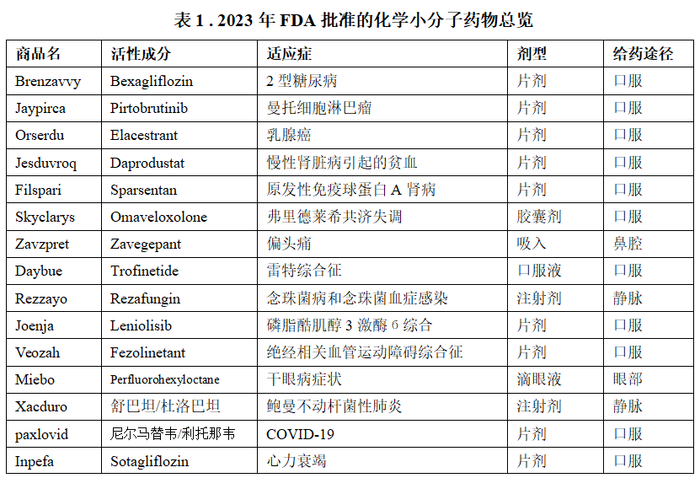
如上表所示,2023年FDA批准的小分子药物中采用静脉注射的产品仅有3款,且均为鲍曼不动杆菌感染、肾透析等需院内用药/紧急用药的适应症,其余均为口服给药产品,占比达到75%。不同于大分子、生物制品、基因治疗等首选注射为给药途径,小分子化药仍以口服为主要的给药途径。
众所周知,新药开发中面临着大量药学变更,但相对于注射剂,口服制剂的变更则相对更为复杂,需要考虑变更前后制剂的药学特性是否一致,生物利用度是否变化,体内暴露是否超过前期暂定NOAEL窗,以及给患者带来的风险,对后续方案制定、数据评估等多个方面的影响。口服制剂变更的策略制定和研究将直接影响到产品推进的速度。
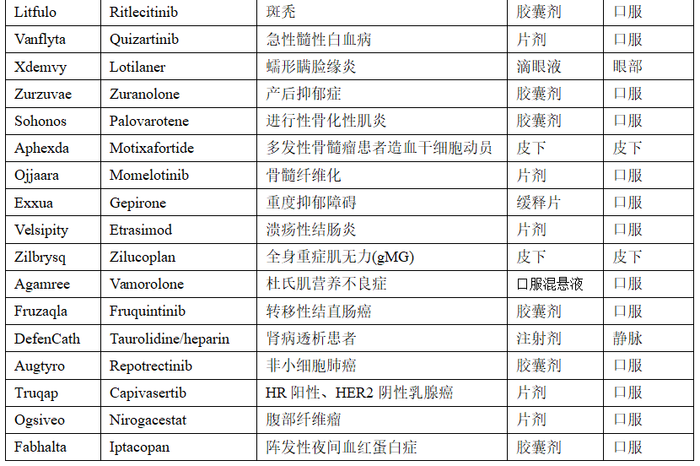
从FDA披露的审评文件可知,在2023年获批的24款口服小分子药物中,剂型和规格、生产场地、以及制剂处方工艺的变更桥接发生频次最高。如表2所示。

备注:其他辅料供应商、批量的变更等未列出,仅列出了在FDA审评文件中“桥接研究”中出现频次高的变更类型
当处方、工艺或外观发生单一变更时,可以参照SUPAC快速确定变更的程度,评估对体内安全性和实验科学性的影响风险,并进行相应的桥接研究。但由表2可知,大多数变更是叠加发生的,在剂型或规格发生变更时通常并行了处方工艺的变更,其研究和策略制定会更为复杂。
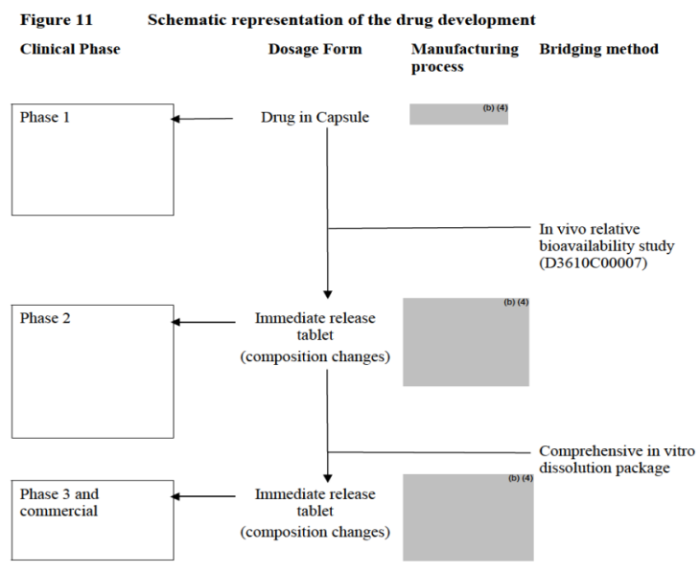
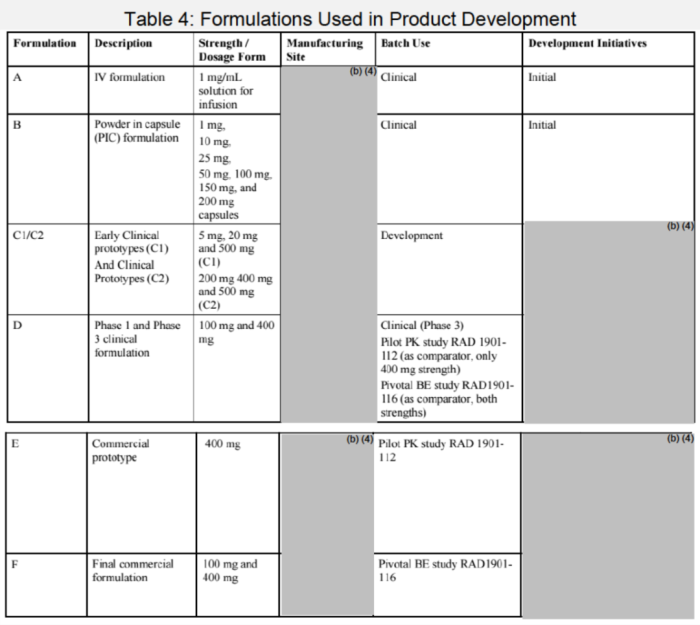
在2023年获FDA批准的Truqap®审评文件中,该产品在临床Ⅰ期使用了胶囊剂,而在Ⅱ期变更为片剂,同时变更了处方和工艺,通过体内相对生物利用度BA研究进行了桥接,如图1所示。
图1:Truqap临床研究期间的变更和桥接历程
在FDA获准的口服制剂中,剂型变更的情形相对较为常见,除上述Truqap®外,Joenia®,Veozah® 、Inpefa®等产品临床期间均有过剂型的跟跌,均对变更前后的产品进行了体内药代动力学及生物利用度的对比,通过BE等效或BA对比桥接变更前后的剂型。大多数产品在剂型变更时叠加了制剂处方、工艺、质量控制、生产场地等方面的变更,比如2023年获得FDA批准的Joenia®,其在Ⅰ期临床使用的是硬胶囊剂,而在Ⅱ期变更为了片剂,同期也变更了处方和生产场地,该产品也通过体内BE研究进行桥接。
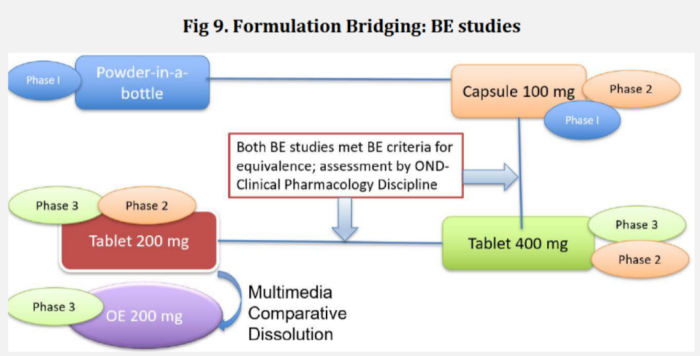
在上述2023年FDA批准的口服制剂中,大多数剂型变更的产品均采用了通过体内研究进行桥接的策略,即:与图2类似,在口服制剂剂型变更时,“BE/BA桥接研究”几乎是“标准操作”。但也有例外,比如2023年获FDA批准的Filspari®,其变更历程如图2所示。
图2:Filspari®的变更桥接历程
如图2所示,Filspari®最早采用装瓶的药物粉末进行早期的口服给药研究,随后采用100mg规格胶囊剂完成了部分Ⅰ期和临床Ⅱ期,在后续胶囊进一步变更为片剂,以及处方规格变更时进行了体内BE/BA桥接。但临床最早使用的瓶装药粉和胶囊剂之间没有进行体内桥接(虽然两者间有过一个BA对比的“预”实验)。
相似的,ORSERDU®也在临床初期使用了药粉装瓶给药的形式,后采用片剂(处方D)完成了临床Ⅰ期和Ⅲ期临床考察,其最初的药粉和片剂之间是没有进行体内BE/BA桥接研究的,如图3所示。
图3 ORSERDU®的药学变更历程
同样的,Litfulo®的临床Ⅰ期采用口服溶液剂进行了单次给药剂量递增考察,而后改为片剂继续推进多次给药剂量递增、药物相互作用等其他Ⅰ期以及后续的Ⅱ期试验,最早的口服液和片剂之间始终未进行桥接研究。这些产品的相同点在于:在临床初期的最初剂型仅应用到了一小部分初期的Ⅰ期试验方案中,而变更后的剂型完成了其余大部分的Ⅰ期研究和后续的临床研究。
从上述案例可知,剂型变更时通常叠加了处方、工艺、生产场地等多个方面的变更,通过体内药代动力学和生物利用度研究进行桥接几乎是“标准操作”;但也有产品在临床初期的少量试验中采用了药物溶液、药物粉末等简单形式给药,以更快获得化合物口服后的体内特征。
在变更指导原则中,将生产场地的变更(除口服固体制剂临床研究早期外)视作重大变更。当前,我国自主研发的泽布替尼、Fruzaqla®(呋喹替尼)均已在美国上市,从FDA公布的审评文件中可知其变更历程。
Fruzaqla®(呋喹替尼)胶囊为普通口服制剂,采用原辅料混合后直接充填胶囊的工艺,临床期间处方工艺保持一致(处方略有变更但评估为微小),仅涉及了生产场地的变更。在临床期间涉及了3个不同的生产场地,其变更策略采用了体内桥接。如图5所示
图5:呋喹替尼的变更历程
如上图所示,呋喹替尼在临床Ⅰ期、Ⅱ期和Ⅲ期的制剂由三个不同的场地生产,每次变更均进行了BE桥接。其Ⅲ期制剂场地同时也为拟上市样品的生产场地,同时,NDA申报时还另申报了一个额外场地作为备用。基于前期BE研究结果证明了溶出前段的快慢不影响体内暴露量和变异,且本品为快速释放产品,处方工艺简单,备用场地的变更通过体外溶出对比进行桥接,未进行体内BE研究。
与呋喹替尼的情况类似,早期在2019年获得FDA批准的泽布替尼也为粉末直接充填胶囊的普通口服制剂,临床期间处方保持一致,仅涉及生产场地的变更。在其开发历程中涉及5个不同生产场地,和呋喹替尼采用的变更策略不同,泽布替尼的NDA申报中证明了每个场地的设备、工艺参数、过程控制和历史释放数据等均完全相同,并提供了不同场地生产样品的f2相似因子,最终FDA同意该产品通过体外溶出对比进行桥接,无需进行体内对比桥接研究。
综上,生产场地的变更策略制定基于变更发生的临床阶段、产品的特性、叠加的其他变更、品种的特点等方面综合考虑制定。但同时也从上述案例中窥见,其策略制定还可能基于公司自身策略的考量:在呋喹替尼的案例中,有了Ⅰ期、Ⅱ期和Ⅲ期不同场地样品的溶出和体内BE数据,在增加备用场地时,虽然备用场地样品和临床样品溶出略有差异,但前期多次BE考察结果证明了溶出前段的快慢不会对体内暴露量和变异程度造成显著影响,最终顺利通过体外溶出研究完成了桥接。
当处方、工艺或外观发生单一变更时,可以参照SUPAC快速确定变更的程度,评估对体内安全性和实验科学性产生的风险,并进行相应的桥接策略选择。如上述呋喹替尼的FDA审评文件中指出,其不同生产场地之间的样品处方稍有差异,但仍然为相似处方,可认为在临床Ⅰ到Ⅲ期的处方一致;再比如在更早获批的普瑞巴林胶囊,其临床期间多次发生胶囊壳颜色的变更,但可归属于微小变更,只需体外对比研究即可进行桥接。在2023年获批的Brenzavvy®的临床期间处方保持一致,仅工艺有微小变更,申请人证明了其不会对产品质量产生影响,因此也无需进行体内桥接。
从2023年获得FDA批准的Jaypircatm®的研究历程中可见,其最早采用T1处方的片剂进行了部分Ⅰ期临床研究,后续的研究采用了T2处方的样品,两个处方之间辅料用量不相似。FDA认为其仅通过体外溶出不足以对两个处方进行桥接,推荐进行体内药代动力学考察和对比。但申请人认为根据前期临床研究获得的群体药代学数据,T1和T2两个处方的药代特征是一致的,因而其处方的变更是合理的,最终受到FDA的认可,仅通过体外研究完成了桥接。
从上述案例中可见,当处方、工艺或外观等发生单一变更时,可根据SUPAC等指导原则判断其变更的程度,对微小变更可进行体外对比研究进行桥接;而重大变更,则需要评估变更前后体内暴露量变化的风险,超出暂定安全窗的可能性,以及对后续方案制定和临床结果解读等方面的影响来制定变更研究策略。
从2023年获FDA批准的创新药剂型分布看,口服给药途径由于其便捷性、顺应性等方面的优势,在小分子创新药的开发中是最为重要的给药途径之一。而口服制剂在临床研究期间可能发生处方、工艺、生产场地等方面的变更,相应药学研究策略的选择和制定将对产品的推进造成直接影响。
从FDA披露的信息看,2023年获批口服制剂临床研究期间发生频率较高的变更包括:剂型、生产场地、处方工艺等方面。还可从中窥见各产品药学变更研究策略多样:①通过体外质量对比完成桥接:有产品在临床期间尽量保持了处方工艺一致/变更程度微小,也有产品通过群体pK数据证明变更不影响体内暴露,最终都豁免了体内药代动力学的研究和对比。②通过体内药代动力学研究完成桥接:有产品在临床期间多次剂型变更,虽然变更后需要进行体内BE/BA对比桥接,但该策略下可以更早的获取新分子在人体内应用数据;也有项目变更时更倾向进行pK对比,以收集不同样品的溶出、PK数据,这可能利于后续临床数据的剖析、再次变更时体内暴露的预测、药学研究溶出区分力的判断、甚至上市后变更时的风险管控等各个方面。总的来说,从这些项目的FDA披露信息中窥见到,变更策略的制定可能是对产品本身特性、当前临床阶段、变更内容和叠加情况、临床暴露量变化风险、临床方案制定和解读科学性,以及项目顶层设计、竞争激烈程度等各个方面综合考量的结果。
撰稿人 | 远志 同写意
责任编辑 | 邵丽竹
审核人 | 何发


















评论
加载更多