siRNA药物开发的三个挑战!
01
尽管siRNA药物在临床中的应用前景广阔,但其开发面临着关键性的挑战:靶向积累和细胞摄取(Entry)、内吞体和溶酶体逃逸(Escape)、以及体内药物性能(Efficacy)(三个“E”挑战)。
1.1“Entry”挑战:靶向积累和细胞摄取
首先面临的挑战是siRNA有效富集于靶器官/组织中,接着有效内化到靶细胞中(图1)。siRNA在体内面临着清除的风险:
①纳米载体封装的siRNA通常与血清蛋白结合,随后被网状内皮系统(RES)摄取和吞噬清除;
②siRNA可以被血浆、组织和细胞质中的核酸酶或磷酸酶快速降解。
③siRNA无法到达靶细胞:siRNA必须穿过毛细血管内皮进入靶组织,但由于广泛的粘附和紧密连接,以及有效的交叉屏障、血脑屏障(BBB)和血视网膜屏障,siRNA到达靶细胞困难重重。
④此外,在实体肿瘤中,由于增强的渗透性和滞留性(EPR)效应,siRNA还可能被动地积累在肝脏或肿瘤组织中。
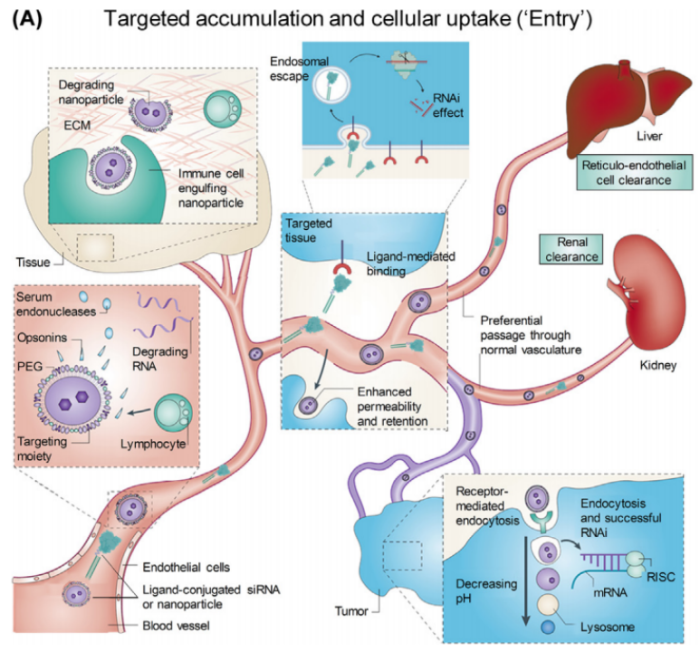 图1:siRNA通过血管、肝脏和肾脏等器官的清除,并积聚在肝脏和肿瘤中
图1:siRNA通过血管、肝脏和肾脏等器官的清除,并积聚在肝脏和肿瘤中
1.2“Escape”挑战:从内吞体和溶酶体中逃逸
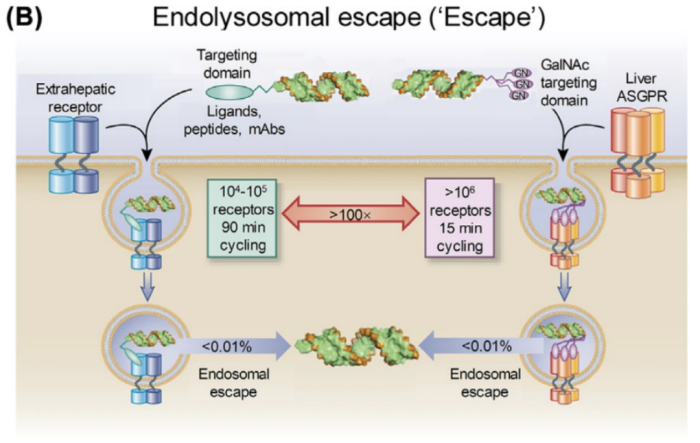
第二个挑战是如何逃脱内吞体和溶酶体。虽然siRNA可以通过内吞作用进入细胞,但只有不到1%的siRNA可以从内吞体逃逸,被动siRNA逃逸率小于0.01%。
唾液糖蛋白受体(ASGPR)是一个明显的例外,肝细胞表达水平约为50万或更高,循环时间小于20 min。过量的GalNAc-siRNA偶联物可以在肝细胞的细胞质中积累,以达到治疗水平。这给未来基于RNA靶向的肝脏治疗带来了希望。
对于其他类型的细胞来说,siRNA如何逃逸仍然是一个未解决的问题。大多数表面受体的表达范围为10000-100000或更少,受体的循环时间90 min及以上(图2B)。由于siRNA在细胞质和内吞体中的降解,研究者观察到在任何给定时刻,只有少量的GalNAc-siRNA偶联物存在于细胞质中。因此,虽然内吞RNA治疗剂像仓库一样,可以维持较长的单剂量反应时间,但大量内吞RNA治疗剂无法穿透细胞质,也就无法起效。当然,也不要一味的追求内吞体的释放,需要有一种平衡来维持释放和储存,确保在较长时间内持续产生反应。
1.3“Efficacy”挑战:体内药物性能
第三个挑战是siRNA在体内需要良好的稳定性、持久的效果和安全性。
交付系统存在副作用风险。使用病毒载体在体内传递核酸具有一定的毒副作用,目前主要局限于临床前研究。临床上主要使用化学合成的载体系统,如阳离子脂质和大多数无机纳米颗粒,但也有诱导细胞凋亡和炎症的风险。另外,在生物体内进行的交付系统还必须确保易于生产、质量控制和运输,以便实现大规模临床应用。
尚未建立RNA药物的临床前毒性评价模型。由于非灵长类动物(NHP)与人类基因组序列的重叠有限,因此从小鼠模型中获得的RNA药物剂量-反应关系不能直接应用于人类,也就无法预测药效。或许可以扩大对非人灵长类动物的使用模型,或选择与疾病相关的类器官作为评价模型。
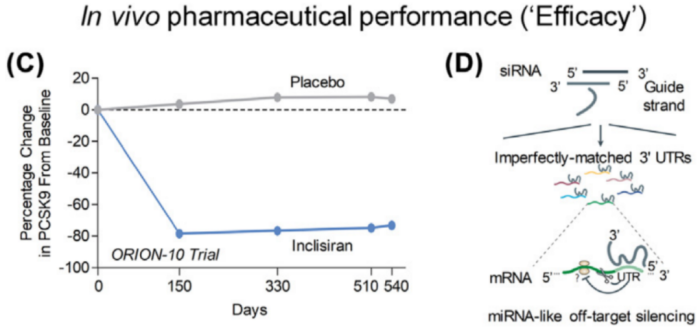
此外,外源性寡核苷酸可能表现出免疫原性,引起免疫反应。随着技术的突破,化学修饰已经被广泛地应用于提高siRNA的性能,如增强siRNA的稳定性,减少/消除脱靶效应和免疫原性等。尽管化学修饰取得成效,能够低剂量长效沉默基因(图3C),然而挑战仍然存在,例如脱靶诱导毒性(图3D)。
因此,siRNA药物的毒性和免疫原性在临床前和临床研究中都需要仔细评估。
02
如何克服这三个“E”挑战?
为了应对这些挑战并推进siRNA疗法的发展,下面分享4个值得探索的策略。
2.1 开发新的化学改性方法
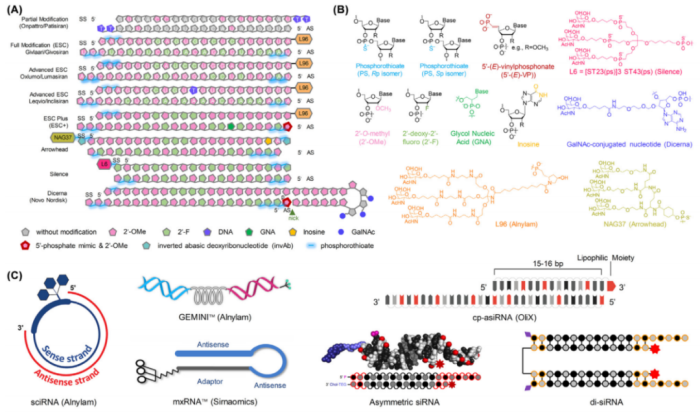
优化化学修饰能够提高siRNA的稳定性、特异性、安全性和生物利用度。这包括开发新的化学改性单体、修饰模式和RNAi触发结构(图4)。
传统siRNA修饰主要包括2’-O-甲基化、2’-flu-脱氧核糖核酸和PS,而新的修饰单体和修饰模式的发展将会进一步控制siRNA的药代动力学和安全性。例如,新的单体,如乙二醇核酸和5′-(E)-乙烯基膦酸盐(图4B);新的修饰模式,如增强化学稳定性的ESC+(图4A);以及新的RNAi触发结构,如小环状干扰RNA(sciRNAs)、不对称siRNA和二价siRNA支架(图4C)。
此外,siRNA的设计和修改现在可以使用算法来实现。例如,Alnylam已经开发了几代siRNA设计,包括部分siRNA改良的、标准模板化学(STC)、ESC、高级ESC、ESC+和IKARIATM,目前几种ESC+偶联物正在临床管道中使用。在专利方面,新入局者通过发展新的单体、模式和结构能够绕过现有的知识产权。此外,商业合作期间的公开许可协议可以为其他公司提供使用siRNA技术的机会,促进其推广和商业化。
2.2 建立独特的配送体系
目前,已经有各种纳米材料被开发为siRNA载体,如LNPs、聚合物、无机纳米颗粒和外泌体,但负载能力、稳定性、安全性和性能仍有局限性。
未来的基础研究应侧重于优化这些载体的理化性质,并利用独特的靶向配体或化学基团特异性结合病变细胞表面标记物/受体。不同于纳米颗粒,siRNA可以与配体共价连接,形成配体-siRNA偶联物,能够降低循环中的清除率,增强靶向积累和细胞摄取,从而调节其药代动力学和药效学试剂。这些配体包括小分子、脂质、多肽、配体、抗体、蛋白质、糖类和非编码RNA(ncRNA)(图5)。
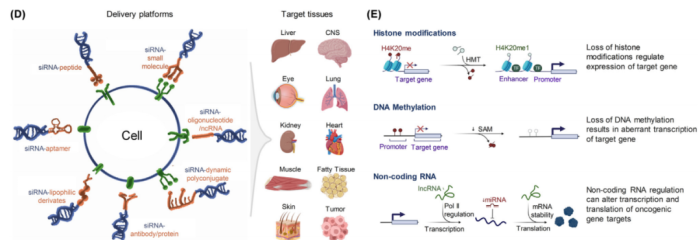
图5配体- siRNA偶联物
2.3 扩大疾病目标
siRNA技术主要用于靶向蛋白质编码基因。然而最近的研究表明,ncRNAs在多种疾病中发挥着重要作用(图6)。因此,靶向ncRNA或许可以覆盖更多疾病,带来更好的治疗方案。另外,探索编码RNA和ncRNA之间的相互作用,不仅可以对疾病机制产生新的见解,还能进一步实现更有效的治疗干预。
除了在mRNA水平上调控基因表达外,siRNA技术还可以靶向表观遗传修饰,如DNA甲基化或组蛋白修饰,这些修饰在疾病的发生发展过程中起着至关重要的作用。通过调节表观遗传标记,有可能重编程基因表达模式和逆转疾病表型。
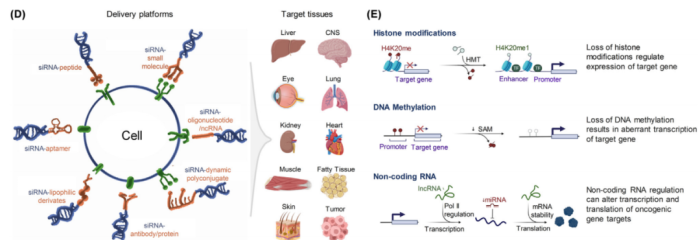
图6组蛋白修饰、DNA甲基化和非编码RNA构成三种不同的表观遗传调控机制
2.4 探索联合治疗
利用双靶向方法将siRNA与其他治疗药物联合使用,如化疗药物、抗体或免疫调节剂,有望提高疗效、克服耐药性和减少脱靶效应。
03
小结
我们正在见证一个新时代的曙光——RNA药物治疗。尽管存在挑战,siRNA仍然是一种很有前景的方法,能改变多种疾病的治疗方式。为了实现高效和安全传递、内吞体释放、体内药效,我们可以探索不同的配体-siRNA偶联物,扩展潜在的疾病靶点,挖掘新的修饰结构,以及开发联合疗法,以促进siRNA疗法的临床转化。相信跨多个领域的持续创新和协作最终会在RNAi治疗领域产生有价值的突破。
撰稿人 | BiG生物创新社
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多