行业专家对在生物药生产中采用连续工艺的看法
连续生产 (CM) 是一种生产产品的方式,在这种方式中,原材料不断被送入生产过程并在其中移动,而在输入到输出的转换之间没有任何可辨别的离散转换。与批次生产相比,CM 具有多项优势,例如稳态操作、减小设备尺寸、高单位体积生产率、短循环时间以及降低资本成本。这导致多个行业(包括食品加工、钢铁制造以及化学和石化生产)的许多公司将其生产流程过渡到 CM。然而,由于技术和监管方面的挑战,制药行业并没有那么快地大规模采用 CM。
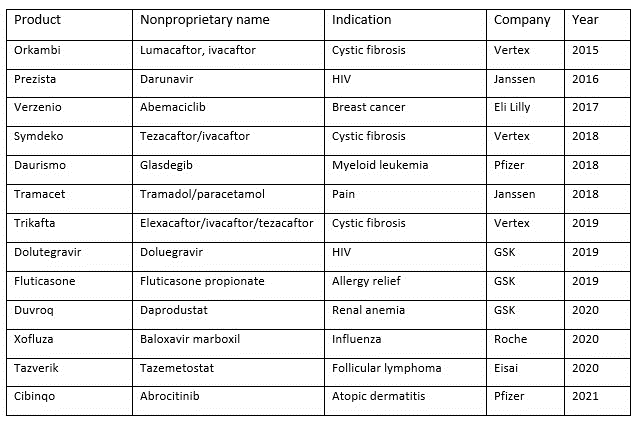
使用 CM 制造的药品清单很短(下表 1)。截至 2022 年,只有 13 种使用 CM 制造的药物在欧洲、日本和美国获得批准,其中的几种药物,如辉瑞的肿瘤药物 Daurismo (glasdegib),最初是通过批次生产工艺获得批准,然后再过渡到之后的CM的。
表 1. 2015 年至 2021 年 FDA 批准的使用连续生产的药物
使用 CM 制造的获批产品的缺乏并不反映目前正在进行的重大努力,以适应这种方法来制造药物。许多公司正在寻求将 CM 工艺添加到他们的产品管线中,并与学术机构合作,以创新连续工艺。随着这些努力取得成果,该行业也开始关注如何使 CM 适应生物药的生产,生物药占每年进入市场的新疗法的大部分。值得注意的是,是否所有生物药产品都适用于 CM 仍存在争议。
许多生物药的制造流程从细胞培养开始,以生产生物药,为此存在几种不同的方法。最常见的方法是补料分批,它使用大罐培养细胞长达三周,然后细胞最终消耗掉所有的营养物质。然而,补料分批生物反应器并不总是首选方法。在生物药开发的早期,较低的细胞系生产力推动了灌流生物反应器的使用,这种反应器可以通过持续向细胞提供新鲜营养素同时去除废培养基和产物来维持数月的培养时间。灌流生物反应器也是制造不稳定蛋白质(如重组酶或凝血因子)的理想选择,连续收获更利于优化产品质量。然而,补料分批式生物反应器更易于操作和扩大规模,因此它们在之后一段时间内,取代了大多数灌流制造,因为它们的生产率从每升不到 1 g提高到了某些产品的每升超过 4 g。
一
CM 赋予旧技术新的用途
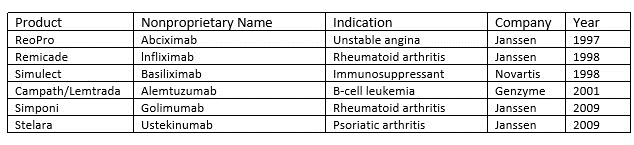
但灌流并没有完全消失,目前一些生物药是使用这种工艺制造的(表 2)。灌流也经历了行业内对开发连续工艺的关注的复兴。这并不奇怪,因为灌流细胞培养的过程输出已被证明明显高于传统的补料分批工艺,因为细胞密度显著更高,生物反应器停机时间减少。此外,灌流工艺需要的设备占地面积比补料分批工艺小得多。这些好处对于任何生物药的生产都可能意义重大,但对于针对相对较少的患者群体的产品尤其重要,因为在这些情况下,在设备和空间上的大量前期资本支出可能没有经济意义。例如,赛诺菲 (Sanofi) 已经证明了将集成式连续灌流用于其罕见病酶替代管线的商业可行性,其中包括用于迟发性庞贝病的 Nexviazyme(avalglucosidase alfa-ngpt)。
表2. 使用连续生产制造的mAb
选择在 1993 年至 2014 年期间使用 FDA 批准的连续灌流生产的许可 mAb 产品样本。
使用灌流生物反应器还可以通过在生产过程中保持均匀的微环境、同时最大限度地减少产品停留时间的可变性,来提高产品质量。例如,中国仓鼠卵巢 (CHO) 细胞在批次细胞培养开始阶段分泌的单克隆抗体 (mAb) 被释放到营养丰富的环境中,其中几乎没有裂解细胞。在批次工艺过程中,抗体在收获前会在生物反应器中保留多天,随着培养基的消耗以及废物和死细胞的积累,开始和结束之间的条件可能会发生巨大变化。多项研究表明,mAb 的许多糖基化、脱酰胺和聚体变异性是由批次工艺过程固有的宽范围停留时间引起的。在连续灌流工艺过程中,单克隆抗体从培养体系中去除,并在形成后立即进入下游工艺,从而减少长时间暴露于批次或补料分批反应器中不断变化的细胞培养条件。对于一些细胞疗法等半衰期较短、稳定性较差的产品,生产反应器中的停留时间更是一个问题。
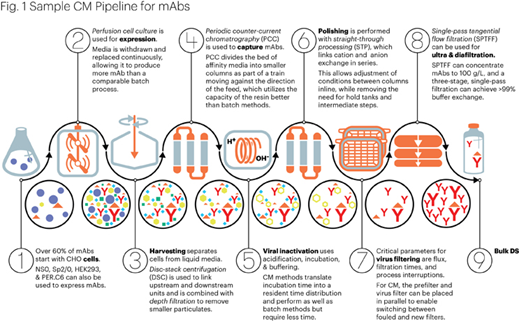
(Figure by Mark Verdecia of USP.)
然而,实施灌流工艺不仅仅是延长运行长度的问题。如果灌流工艺不稳健且生产力不高,那么这样做并没有真正的优势,因为给定空间和时间的产量仍然很低。因此,优化灌流工艺对于实现最大产量是必要的。最近,Transcenta 使用专有的连续灌流细胞培养平台进行为期 4 周的培养,实现了每天大于 6 g/L 的单位体积生产率。这一改进使产量增加了 15 倍,使一个 500 L的一次性生物反应器每年可以生产大约 600 kg的总原料药。其它公司,包括 Sartorius Stedim Biotech,已报告使用 100 L 灌流生物反应器可达到 5,000 L 补料分批生物反应器的预期产量。
二
其它创新显示出有助于行业采用的承诺
其它创新,包括切向流过滤 (TFF) 和交替式切向流 (ATF) 过滤等分离技术,也在影响着该行业。ATF 的较低剪切应力使制造商能够提取含有目标蛋白质的废培养基,同时将更高百分比的细胞安全地返回生物反应器。这有助于该工艺保持较高的细胞密度并减少额外澄清步骤的需要。
CM 在生物药领域的未来不仅仅是细胞培养。将上游和下游单元操作集成到完整的端到端 CM 或部分 CM 中可以提高效率,从而显著降低成本。据报道,相对于 mAb 生产的传统批次操作,集成的连续生物生产平台可将工艺成本降低 55%。非单克隆抗体产品有可能更大幅度地降低运营成本并将资本支出减少三倍。据报道,一些公司已经实现了这一飞跃。BiosanaPharma 报告了目前处于 1 期临床试验阶段的 mAb 的完全连续生产工艺,Enzene Biosciences 最近在印度开设了一座完全连续的生物药生产工厂。
将 CM 用于生物药的许多障碍是产品纯化所需技术所固有的。例如,相比CM,结合/洗脱层析更便于批次生产,而最终制剂条件通常仅在批次洗滤工艺结束时达到,这不一定有利于 CM。然而,在解决这些技术限制方面已经取得了重大进展。解决方案包括流穿式层析系统和逆流分级洗滤工艺,以及自动层析柱和过滤器切换系统。
有助于采用集成 CM 的其它发展是适当的过程分析技术 (PAT),用于快速入线或近线评估关键过程参数和关键质量属性,以确保过程保持受控。使用 PAT 可以非常有利于加快工艺开发、提高过程理解以及建立稳健的控制策略。然而,PAT 仍不成熟,特别是对于较大的分子。虽然 pH、UV 和电导率的入线测量很容易实现,但其它参数(如聚体、生物负荷和糖基化)的快速分析更具挑战性,可能需要开发新技术和方法。幸运的是,在业界等待这些技术上线的同时,它仍然可以实现 CM 的许多好处,包括提高生产率、缩短工艺开发时间、降低运营成本、最小的人为错误以及更小的生产占地。
尽管做出了这些努力,实施 CM 工艺、以链接或整合操作的已知生物药制造商的数量仍然很少,即使在过去五年中,这个数字已经显著增长。
三
制造商需要考虑 CM 是否适合他们
在采用 CM 之前,制造商必须评估用于生产其管线中产品的可用设备和设施的成本、业务案例和技术可行性。
如果您选择采用 CM,您将需要转变思维方式,以新的方式思考生物药的生产。产品质量可变性仍然需要在多个批次或生物反应器工艺的多天培养中进行评估。在批次生产中,批次由生产的材料数量定义,但 CM 可以通过多种方式定义批次,包括按时间而不是所有单元操作完成时生产的原料药数量。因此,想要实施 CM 的制造商必须在其质量体系内进行程序更改,以实现批次定义的灵活性。制造商还需要了解瞬态事件如何影响单个单元操作和整个 CM 流程。了解瞬态事件的影响对于识别产品质量风险至关重要,无论这些风险是计划内事件(例如过程启动、暂停或关闭)还是计划外事件。处理这些问题需要稳健的控制策略,因为 CM 需要快速的实时决策来保持过程的控制和自动化,从而能够快速响应并灵活地对不断变化的条件做出响应。CM 控制策略的一个关键要素是实时转移不合格 (OOS) 材料,以帮助保持整体产品质量。
如前所述,采用 CM 存在多个经济和运营原因,但制药行业的制造商还必须遵守非常高水平的监管监督。获得生物产品的监管批准已经非常耗时,且需要大量人力投入。可以理解,制造商担心任何可能延迟其产品的批准和商业化的事情,尽管监管机构已经承认 CM 可以提高质量、提高效率、解决医疗产品短缺问题并加快上市时间。
四
知识共享和监管机构的投入将刺激 CM 的采用
缺乏对生物药连续工艺的开发、实施、操作和生命周期管理的科学和法规指导会产生风险。目前的指南,包括 ICH Q8、Q9、Q10 和 Q11,对于批次生产工艺的内容可能很容易理解,但它们对 CM 的实施的指南仍在不断发展。即将出台更具体的指南,包括 ICH Q13,它侧重于治疗性蛋白质的 CM。然而,行业需要监管机构提供更多信息,监管机构需要行业提供更多信息。幸运的是,FDA 正在优先考虑先进制造,并为其新兴技术计划增加人员,该计划评估连续、模块化和智能制造。
行业组织也开始在促进 CM 的使用方面发挥积极作用。美国国家生物制药创新研究所促进了一项关于 mAb 制造的案例研究,旨在就 mAb 的 CM 控制策略的实施达成共识。行业组织 BioPhorum 也有一个关于连续生物工艺的工作流,作为其生物制造技术路线图的一部分。
该行业需要促进者来帮助促进知识的创造和共享,这将使监管机构能够适当地平衡风险和运营效率,同时使制造商能够在实施 CM 时做出正确的决策。所有相关方之间的竞争前协作和知识共享将帮助该行业更快地获得大量关键知识,这是确保技术当前利益所必需的。
原文:R. Chen, C.Hwang, K. Lee, et al., Where Do We Stand On Adopting Continuous Manufacturing For Biologics? Bioprocess Online, 2022.
撰稿人 | R. Chen, C.Hwang, K. Lee, et al. 生物工艺与技术
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多