ADC的未来将如何发展?
2009年,卡利霉素、金盏花素和美登素类药物是用于ADC开发的主要细胞毒素。十年来,这些分子仍然被用作有效载荷进行优化,以获得更好的稳定性和亲水性。新的细胞毒性物质也被开发出来,如PBDs、杜卡霉素和喜树碱衍生物等。
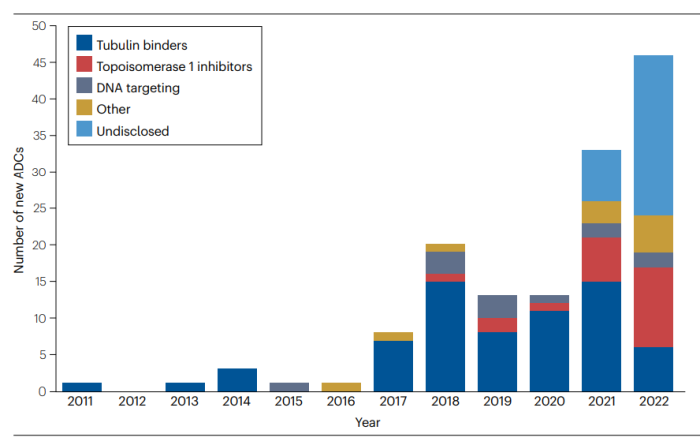
抗体工程在10年间也已经取得了相当大的进展,允许更多的位点特异性偶联,提高了ADC的均一性和稳定性。新的第二代和第三代ADC已经进入临床,以期获得更好的治疗效果和安全性。几十种基于半胱氨酸残基、非天然氨基酸或分子工程模式的生物偶联技术也已经在临床前研究获得了验证。目前,FDA已经批准上市了15个ADC药物,还有上百个ADC药物正处于临床研究阶段。可以预期授予ADC的上市批准将更加多样化,其适用的疾病适应症也将更加多样化。
ADC的未来发展将包括更多新的靶抗原、具有新作用机制的有效载荷、可以提供更好治疗指标的新连接子偶联技术以及新的抗体和载体形式。
监管机构预计很快将审核几种不同于已批准抗原的靶向ADC,从而扩大可用于抗体导向治疗的癌症适应症的范围。这些有希望的靶点包括ROR1、HER3、CEACAM5、MET和NaPi2b。
ROR1是一种调节中枢神经系统中轴突生长的孤儿受体,它在胚胎早期发育过程中高水平表达,而在成年组织中低表达。许多研究表明,ROR1在恶性肿瘤细胞中高表达,其最初被鉴定为血液系统恶性肿瘤中的肿瘤胚胎基因。除了血液系统恶性肿瘤外,ROR1的异常表达也作为生物标记物和治疗靶点在多种实体瘤中被发现。NBE-002是一种针对ROR1的蒽环类抗体偶联药物,目前正在晚期实体瘤患者的I/II期研究中进行评估(NCT04441099)。
HER3在多种癌症类型中过表达,并被认为可预测不良预后。尽管缺乏显著的激酶活性,但HER3通过HER3同源二聚化或HER2/HER3异源二聚化发挥其功能,从而激活下行信号通路以促进细胞存活和增殖。重要的是,HER3信号已被证明与抗EGFR/HER2疗法的耐药机制有关,并且正在成为EGFR突变NSCLC的一个有希望的治疗靶点。Patritumab deruxtecan(U3-1402)是目前唯一一个正在进行临床研究的ADC。目前,针对HER3阳性转移性乳腺癌的I/II期研究(NCT02980341)正在进行中。
CEACAM5是一种细胞表面粘附分子,已被用作诊断标志物和肿瘤靶点。几种靶向CEACAM5的ADC目前正在进行临床试验,包括用于非小细胞肺癌(NCT05245071)、乳腺癌和胰腺癌(NCT04659603)患者的tusamitamab raftansine/SAR408701,以及用于晚期结直肠癌患者的M9140(NCT05464030)。此外,Labetuzumab-govitecan(IMMU-130)已在临床前模型中显示出良好的抗肿瘤活性,拟用于严重预处理的转移性结直肠癌患者。
间充质上皮转化蛋白(MET)是一种受体酪氨酸激酶,属于RTK的一个独特亚家族。MET是一种调节上皮癌发生、发展和恶性肿瘤的致瘤决定因子,并在几种实体瘤类型中过表达。一些靶向MET的ADC目前处于临床试验阶段,包括telisotuzumab vedotin(NCT03539536)、HTI-1066(NCT03398720)、SHR-A1403(NCT03856541)、BYON3521(NCT05323045)、RC108(NCT04617314)和TR1801(NCT03859752)。
NaPi2b是一种pH敏感的钠依赖性磷酸盐转运蛋白,在各种肿瘤类型中过表达,特别是卵巢癌。Upifitamab rilsodotin是一种以NaPi2b为靶点的ADC,目前正在进行第三阶段临床试验(NCT05329545),用于治疗卵巢癌症。
ADC的最初模式是基于细胞毒性有效载荷的细胞内释放,从而杀伤肿瘤细胞。现在,基于ADC的分子特性,人们发现并利用了许多新的作用机制,进一步拓展ADC的治疗潜力。
触发免疫原性细胞死亡
越来越多的研究涉及ADC的免疫刺激特性。除了免疫刺激剂本身的偶联,如免疫刺激抗体偶联药物(iADC),ADC还可以诱导免疫原性细胞死亡(ICD),从而促进抗肿瘤免疫反应。ICD是一种死亡细胞导致的适应性免疫反应过程,可由某些类型的细胞毒性化疗药物或靶向药物引起。
ICD的诱导是ADC与免疫检查点抑制剂联合治疗的基础,特别是在霍奇金淋巴瘤等免疫浸润丰富的癌症类型中。ADC有效载荷诱导ICD的能力可能不同,更多的研究将有助于确定其作为免疫激活剂的潜力。
靶向细胞外抗原
ADC的旁观者效应以及有效载荷在肿瘤内扩散的能力是许多ADC靶向实体瘤的机制中未被充分重视的部分,其取决于有效载荷的物理化学性质和效力。另一方面,人们也开始聚焦于靶向肿瘤微环境细胞外成分的非内化抗体。例如,靶向tenascin C剪接结构域的PNU抗体偶联药物在临床前模型中诱导了肿瘤的完全消退。类似地,由肿瘤细胞分泌的半乳糖凝集素-3结合蛋白也已被探索为细胞外ADC靶标。但这种创新的机制也面临着特定的困难,包括靶抗原在正常组织与肿瘤组织中的相对表达、有效载荷在环境中的充分释放以及有效载荷在肿瘤细胞中的有效渗透。
调节免疫抑制肿瘤微环境
除了靶向肿瘤细胞本身和细胞外抗原的第三种策略是靶向免疫细胞。已有研究表明,抗CD45 ADC可以在接受异基因造血干细胞移植的小鼠中成功进行骨髓清除,从而避免全身照射或暴露于强效烷化剂。最近在一项I/II期研究中报道了一种清髓性CD117鹅膏素ADC,其耐受性良好。随着我们对免疫抑制细胞在肿瘤微环境中作用的了解增加,ADC可能会被开发为清除特定免疫细胞亚群,如调节性T细胞、2型巨噬细胞或髓系衍生的抑制细胞。
目前,一些新的ADC形式正在出现,例如条件性激活、双载荷或双特异性ADC等,目的是增强肿瘤特异性并降低对健康组织的毒性。条件性激活的ADC可以将抗体设计成掩蔽的、蛋白水解可裂解的前药,旨在通过利用肿瘤微环境中高蛋白酶活性来减少非肿瘤靶向毒性。CX-2009和CX-2029是条件激活的ADC,包含MMAE有效载荷,其中一个靶向DC166,另一个靶向CD71。CX-2029由CytomX与AbbVie合作开发,目前正在一项多队列I/II期剂量扩展研究(NCT03543813)中作为单一药物进行评估,CX-2009在实体瘤患者中进行评估(NCT03149549)。
双特异性抗体上偶联有效载荷以产生具有改进的特异性和/或内化特性的ADC是一个新的研究领域,有望克服现有的局限性,如内吞作用、毒性和对ADC的耐药性。目前,一些双抗ADC已进入临床实验阶段,如M1231(NCT04695847)、ZW-49 (NCT03821233)、REGN5093-M114 (NCT04982224)和BL-B01D1 (NCT05262491)。这些双抗ADC多靶向抗TAA,如HER2、HER3、EGFR、MUC1和MET。此外,治疗药物的有效吸收还需要易于内化和溶酶体易位。为了高负载内化到肿瘤细胞中,许多跨膜蛋白,包括催乳素受体(PRLR),细胞因子受体和CD63,可以作为靶点被应用和开发。
双载荷ADC通过不同的构建方法对其药抗比(DAR)进行灵活调整,可以根据疾病类型及治疗目的微调ADC的理化特性、功效和毒性特征,充分利用ADC双药递送的优势,提高ADC活性。目前,双载荷ADC的构建方法已趋于成熟:一种是利用两个反应位点分步进行构建;另一种就是利用单一反应位点引入分支连接子,再通过点击化学组装细胞毒性药物。但是,其药动药代方面的开发依然任重道远。
在过去的十年中,ADCs已经通过选择更好的细胞毒性药物、生物偶联方法、更好的靶向抗原和优化的抗体工程得到了改进。然而,它仍存在一些局限性(如有限的实体瘤渗透性和毒性)以及耐药机制的出现。
为了克服这些局限性,人们研究了新的抗体形式、新的传递系统、非内化抗原靶点、新的细胞毒性药物和位点特异性生物偶联方法来促进ADC的发展。虽然许多创新尚未在临床方案中得到验证,但这一领域的研究为我们提供了许多令人鼓舞的结果。相信ADC未来的十年将会迎来更加辉煌的前景。
参考文献:
1. Antibody–Drug Conjugates: The Last Decade. Pharmaceuticals 2020, 13, 245
2. Antibody–drug conjugates come of age in oncology.Nat Rev Drug Discov. 2023 Jun 12.
撰稿人 | 小药说药
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多