手把手教你-AAV线性放大生产工艺详解
人胚胎肾 (HEK 293.2) 悬浮 (sus) 细胞系作为包装细胞系,通过三质粒转染至细胞生产rAAV5。细胞达到最佳性能取决于多种因素,例如特定细胞克隆的生长和生产力、培养基的组成、搅拌、溶氧和温度等培养条件。在设计细胞培养基时,了解这些因素如何影响细胞代谢过程是至关重要的。了解细胞系的代谢活性、营养需求和排泄物产生有助于确保使用正确的营养物质组合和数量,以最大限度地减少可能导致细胞毒性的排泄物产生。
我们使用HyClone peak expression培养基在摇瓶中培养HEK 293.2 sus细胞,并对细胞的生长、活力和rAAV产率进行了评估。之后使用Xcellerex XDR-10和XDR-200生物反应器对工艺的可放大性进行了研究,并与摇瓶培养工艺的性能进行比较。
一
材料与方法
01
细胞驯化
HEK 293.2 sus细胞 (ATCC) 从BalanCD HEK293培养基 (Fujifilm Irvine Scientific) 转移到HyClone Peak expression培养基中进行细胞驯化,种子细胞密度为5.0×105 细胞/mL。室温下,每3-4天往细胞中加入新鲜培养基进行细胞传代,直到细胞达到24-30小时之间的群体分裂期 (PDT) ,细胞活力超过90%。
02
摇瓶培养
将HEK 293.2 sus细胞接种于装有30-50 mL HyClone peak expression培养基的125 mL摇瓶中,接种密度为0.4×106 个细胞/mL。在摇床中以140 rpm、37 °C和5% CO2的条件进行培养。当细胞计数和活率下降到一定程度时终止培养。细胞培养平行三次重复进行。
03
病毒扩增
通过三质粒转染系统对细胞进行转染。该系统由一个递送腺病毒基因的pHelper质粒、一个Rep/Cap(复制和衣壳蛋白)质粒和另一个在末端反向重复序列 (ITR) 之间包含有目的基因(GOI,在本研究中是指绿色荧光蛋白 [GFP])的质粒组成,这三个质粒对于将目的基因包装到AAV衣壳中必不可少。helper:Rep/Cap:GOI质粒的比例为 2.0:1.5:1.0。在密度为2×106 个细胞/mL的培养体系中,以 2:1 (PEI:DNA) 的比例使用线性化聚乙烯亚胺 (PEI, Polysciences Inc.) 诱导转染。收获时间 (TOH) 为转染后第4天,通过微滴式数字PCR (ddPCR) 检测绿色荧光蛋白 (GFP) 转基因盒,从而确定病毒滴度。
04
病毒滴度
在摇床中,用100 μL 10×裂解缓冲液(5% 吐温 20,10 mM氯化镁,200 mM Tris,pH 8.0)和20 U/mL的Turbonuclease酶处理约900 μL培养物4小时。将等分试样以15,000×g离心10 min,并对粗裂解上清液进行ddPCR分析。
05
生物反应器培养
以0.5×106 个细胞/mL的密度将HEK 293.2 sus细胞接种于装有HyClone peak expression培养基的一次性Xcellerex XDR-10 L细胞培养袋中,生物反应器的最终培养体积为9 L。使用表1中列出的培养参数,在XDR-10生物反应器中进行细胞培养。将细胞从摇瓶转移到 WAVE生物反应器(Xuri细胞扩增系统W25)中,再转移到XDR-200生物反应器中,进行细胞扩增。
表1:生物反应器中细胞培养工艺放大条件
|
参数 |
XDR-10生物反应器 |
XDR-200生物反应器 |
|
培养基 |
HyClone peak expression培养基 |
HyClone peak expression培养基 |
|
工作容量 |
9 L |
180 L |
|
叶轮转速 |
120 rpm(上扬方向) |
158 rpm(上扬方向) |
|
温度 |
37 °C |
37 °C |
|
pH设定值 |
7.3(通过CO2和碱进行控制) |
7.3(通过CO2和碱进行控制) |
|
溶氧 (DO) 设定值 |
40%(通过富氧空气进行控制) |
40%(通过富氧空气进行控制) |
|
O2流速 |
通过比例积分微分 (PID) 进行控制 |
通过PID进行控制 |
|
CO2流速 |
通过PID进行控制 |
通过PID进行控制 |
二
结果
01
采用HyClone peak expression培养基对细胞进行驯化
将保存于BalanCD HEK 293培养基 (Fujifilm Irvine Scientific) 中的HEK 293细胞在HyClone peak expression培养基中直接解冻。3-4天后,细胞分裂至密度为0.4至0.5×106 VC/mL,并维持几次传代培养。对VCD和PDT进行监测(图1)。
使用第5代传代细胞建立细胞库。将细胞冻存于加入二甲亚砜 (DMSO) 的HyClone peak expression培养基中,浓缩至细胞密度为20×106 VC/mL,并将1 mL等分试样转移至冻存管中。将细胞库冻存于CoolCell冻存盒 (Cool Lab, LLC) 中,在-80 °C下过夜,然后将其转移至液氮储罐中。
待多个细胞库冻存管解冻后,我们对细胞的VCD和PDT进行了监测,以确保细胞库的一致性(图2)。
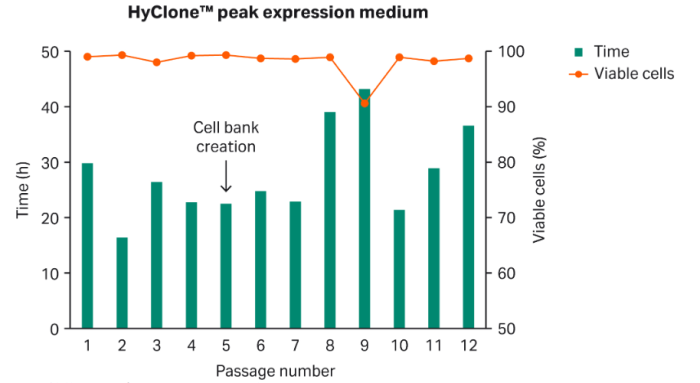
图1:采用HyClone peak expression培养基直接对HEK 293细胞进行驯化
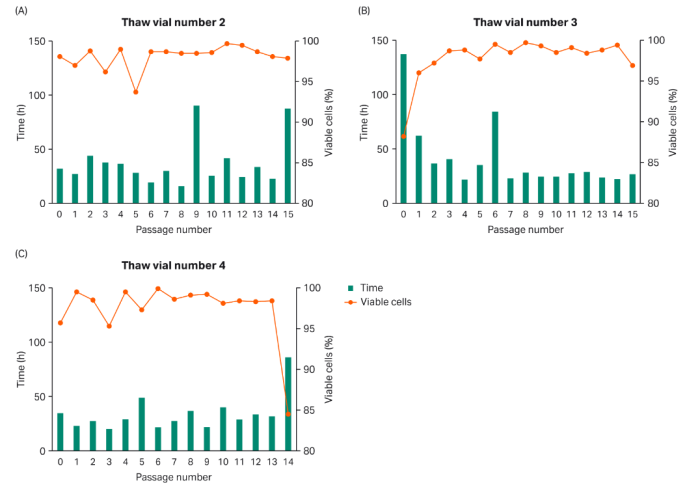
图2:将多个用第5代传代细胞建立的细胞库冻存管解冻后,对细胞进行VCD和PDT监测
02
摇瓶中的高密度培养
在本实验中,我们在摇瓶中用HyClone peak expression培养基培养了不同代次的细胞,培养时间长达13天(图3)。对VCD、细胞活力和PDT进行全程监测。我们可以从图3中看出,HyClone peak expression培养基支持的细胞生长密度范围在6.0-9.0×106 个细胞/mL之间。
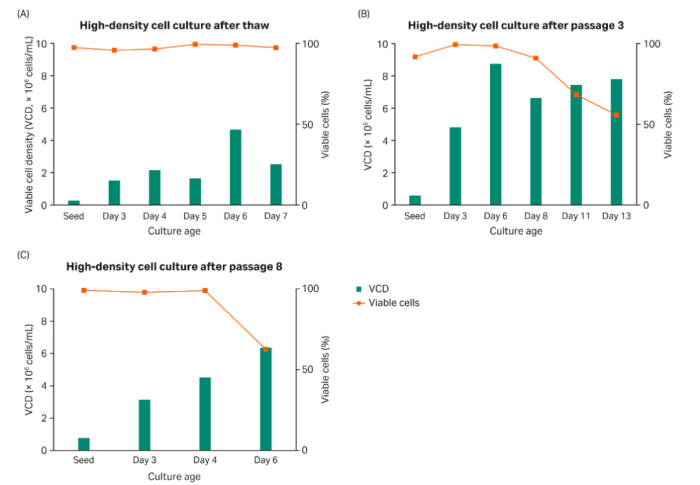
图3:摇瓶中的高密度细胞培养 (A) ,解冻后的细胞培养 (B) ,第3代和第8代细胞培养 (C)
03
在摇瓶中进行瞬时转染优化
采用三重质粒转染法对已驯化的HEK293.2 sus细胞进行瞬时转染。在该过程中,PEI与DNA 形成复合物,然后被导入到宿主细胞中。使用绿色荧光蛋白 (rAAV5-GFP) 对摇瓶中的HEK293.2.sus细胞进行转染,质粒的使用量为每2×106 个细胞对应2 μg DNA。
为研究该培养基对PEI-DNA复合物稳定性的影响,测试了转染复合物在HyClone peak expression培养基中的占比(占rAAV生产总体积的5%或10%)(图4)。每种条件按三次重复在摇瓶中进行实验。结果显示占比为10%时,一致性较好,因此在使用HyClone peak expression培养基的HEK293.2细胞rAAV生产实验中,推荐使用该体积。
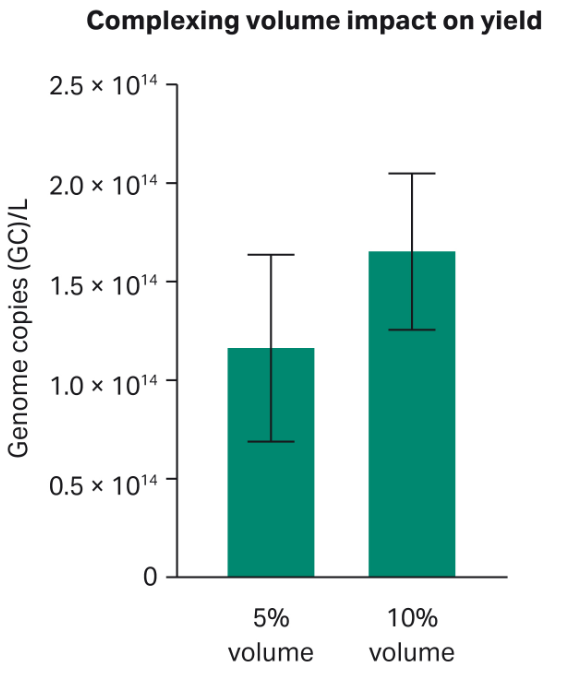
图4:使用HyClone peak expression培养基比较不同体积PEI和DNA复合物(5%和10%)在摇瓶中的转染收率差异。基因组拷贝数=GC
04
rAAV5在生物反应器中的放大生产
最后,我们将rAAV5-GFP的生产进行了放大,由摇瓶培养放大到XDR-10生物反应器培养,然后进一步放大培养到XDR-200生物反应器(图6)。结果显示,虽然与摇瓶培养的产率稍有下降,但总体来说该工艺可在10 L至200 L生物反应器之间进行放大。GFP的百分比峰值出现在转染后第48小时(2天,未显示相关数据)。
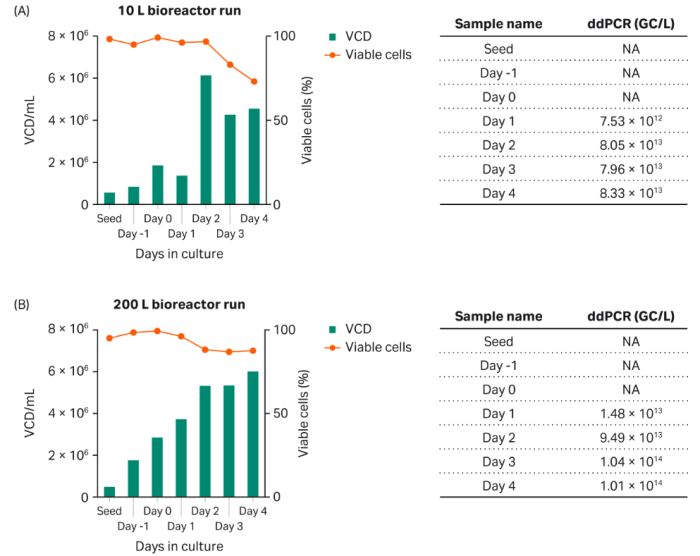
图6:使用 (A) XDR-10生物反应器在10 L培养规格中生产rAAV5-GFP以及使用 (B) XDR-200生物反应器在200 L培养规格中生产rAAV5-GFP。
总 结
重组腺相关病毒载体 (rAAV) ,例如rAAV5血清型,已被广泛用做基因治疗递送系统。XDR生物反应器是常用的培养设备,培养体积为10 L到2,000 L。此平台整合一次性耗材技术和搅拌生物反应器设计的优点,采用M40e斜叶搅拌桨设计,同时具备传统象叶桨低剪切力和斜叶搅拌桨高效混合的特点,深层通气底盘配置0.5 mm、1 mm的大泡通气设计,满足氧消耗的同时降低气泡破裂产生的剪切力,非常适合HEK 293细胞培养。本文研究了如何在Xcellerex XDR-10和XDR-200生物反应器中进行放大性生产,并与摇瓶培养工艺的性能进行比较。
撰稿人 | Cytiva
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多