药物新用途专利保护的价值
医药用途发明的定义
医药用途或新适应证在2020年《化学药品注册分类及申报资料要求》的药品注册分类中,属于2.4类含有已知活性成分的新适应证的药品。
用途发明,是指在发现物质(或产品)的特有性质后,专门利用这种性质而形成的发明。在化合物专利申请中,为了满足说明书充分公开的要求,一般会公开该化合物的至少一种用途。研发机构在对药物的作用机理进行进一步研究的过程中,发现其具有新的作用,如果这种新的作用能够实现本质上不同于现有技术已知的治疗应用,则可以申请用途发明保护。用途发明在医药领域尤为常见,如辉瑞公司研发的著名的磷酸二酯酶5抑制剂西地那非(商品名:伟哥,Viagra),最初只是作为治疗心绞痛的药物,而将其用于治疗男性勃起功能障碍的新用途专利,为辉瑞制药公司创造了巨大的价值[1]。

医药用途发明本质上是一种方法发明,权利要求属于方法类型。不同的权利类型保护的主题不同,因而保护范围也不一样,在权利要求撰写时应当注意措辞。例如,“化合物作为XX的应用”与“作为XX使用的化合物”,即属于不同的权利要求类型,前者属于方法权利要求(用途),而后者属于产品权利要求。
延长药品专利保护期
原研药企业为了独享其新药产品上市后长时间的市场垄断地位,必然会对药品的化合物进行严密的专利布局。但专利的保护期限仅为20年,原研药企业终会面临核心化合物专利到期的困境。通过对已有药品的应用进行研究,开发新的制药用途发明,对于延长专利保护、维持市场的垄断地位具有重要意义。例如诺华公司的发明名称为“胃肠基质肿瘤的治疗”的专利ZL01817895.2号专利(以下简称“本专利”),充分体现了药物新用途专利的价值。
格列卫是诺华公司研发的一种特异性酪氨酸激酶抑制剂,开创了分子靶向治疗的时代,其有效成分为甲磺酸伊马替尼。格列卫于2002年在中国销售,成为治疗费城染色体阳性的慢性粒细胞白血病(CML)的最有效药物。诺华公司针对格列卫产品,在1993年4月2日提交了针对有效成分的化合物专利申请CN93103566.X,该申请于1999年6月2日获得专利授权,保护期满终止日为2013年4月2日。后来诺华公司研究发现,格列卫还可用于治疗成人不能切除或发生转移的恶性胃肠道间质瘤(GIST),并针对该治疗用途于2001年10月26日提交了制药用途专利申请CN01817895.2,该申请于2006年9月27日获得授权,专利保护期满终止日为2021年10月26日。包含该适应证的格列卫于2007年11月获批进入中国。
2013年4月,格列卫化合物专利在中国的专利权到期,江苏豪森药业的仿制药“昕维”被中国药品监管部门获准上市,其凭借治疗效果相同但有明显的价格优势,抢占了格列卫的一定市场。2014年,诺华公司以江苏豪森药业在其甲磺酸伊马替尼仿制药说明书的药代动力学部分提及GIST相关内容而属于侵犯诺华公司专利权为由,向北京市第二中级人民法院提起专利侵权诉讼。作为应对措施,江苏豪森药业以本专利向专利复审委员会提起专利无效宣告请求,并成功宣告本专利权全部无效。专利权人诺华公司不服上述无效决定,先后向北京知识产权法院和北京市高级人民法院提起上诉。北京市高级人民法院于2017年12月7日开庭审理了本案,并于2017年12月20日,北京市高级人民法院作出最终判决,驳回上诉,维持原判。
至此,一方面,江苏豪森药业针对诺华公司的甲磺酸伊马替尼用于制备治疗GIST的制药用途专利发起的专利无效宣告取得了重大胜利,在化解自身专利风险的同时,也为其他仿制药上市排除了专利障碍,有力地推动该药物对中国相关患者的可及性。另一方面,由于诉前禁令的颁布,客观上延缓了江苏豪森药业产品的上市时间,延长了格列卫化合物专利的保护期限,为诺华带来了长达几年的垄断市场利润。
老药新用研究下新制药用途的保护
药物新用途或新适应证是快速发现新药的有效途径,特别适合作为我国的新药研究模式。其具有成药性高、研发经费低(比1类新药开发要低50~60%)的优势,且具有广阔的知识产权空间[2]。
1类新药的发现需要承担高额的研发投入和许多未知的风险,并且随着对药物安全性及有效性要求的不断提高,开发新药的成本还将持续上涨。老药的二次开发具有先天的优势,越来越受到创新主体的重视。一方面,现有技术中已经积累了完整的安全性以及体内代谢吸收的研究数据,在临床开发阶段能够大大缩短研发周期,降低研发费用和投资风险。另一方面,通过制药用途专利对老药新用途的进行保护,获得市场垄断地位,同样能够获得高额的利润回报。如阿司匹林、二甲双胍等,都是老药新用的代表和典范。使用药物重定位策略可找到候选药物的新适应证或新用途。与全新结构药物研发周期长、成本及风险高的特点相比,药物重定位策略缩短了发现药物新适应证或新用途的时间,可大大降低药品研发的成本和研发风险[3]。表4-2-3列出了近年来老药新用的代表,以及其获得用途专利保护状况。
表4-2-3 近年来老药新用的代表
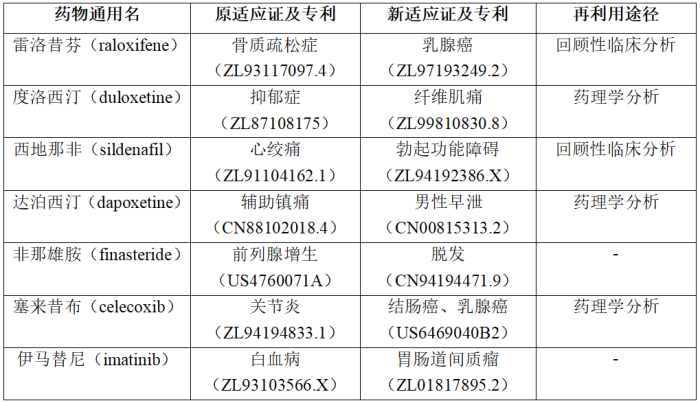
例如,针对表4-2-3中的西地那非,原是辉瑞公司研发计划用于治疗心血管疾病的药物,但临床疗效无法达到预期,1991年4月其临床试验正式宣告失败。后续研发人员成功将其开发成了治疗男性勃起功能障碍(ED)的药物“伟哥”,并成为辉瑞公司的明星产品。辉瑞公司针对该制药用途,获得了发明名称为“用于治疗阳痿的吡唑并嘧啶酮类”的ZL94192386.X专利保护。虽然该专利获得授权的仅有一项权利要求,即“5-[2-乙氧基-5-(4-甲基-1-哌嗪基磺酰基)苯基]-1-甲基-3-正丙基-1,6-二氢-7H-吡唑并[4,3-d]嘧啶-7-酮或其药学上可接受的盐或含有它们中任何一种的药物组合物在制造药物中的用途,该药物用于治疗或预防包括人在内的雄性动物勃起机能障碍”,但其为辉瑞公司带来了高额的市场回报。
本节选自:刘建, 黄璐, 主编. 中国医药企业知识产权管理[M]. 北京: 知识产权出版社, 2021年,第四章第2节,第144-146页. 此部分执笔作者:冯清伟先生
备注:上述涉及药物的2张图片均来源于网络,如涉及侵权,烦请联系作者删除。
【参考文献】
[1] IPRdaily中文网. 为什么医药用途发明专利很特殊?[EB/OL]. (2017-12-11)[2019-06-10]. http://www.iprdaily.cn/news_18044.html.
[2] 黄璐, 钱丽娜, 张晓瑜等. 医药领域的专利保护与专利布局策略[J]. 中国新药杂志,2017, 26(2): 139-144.
[3] 熊阿珍, 孟光兴. 药物重定位候选药物筛选路径[J].中国医药工业杂志, 2020, 51(2): 170-175.
撰稿人 | 福璐娃
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多