FDA咨询委员会是“何方神圣”?在新药评审中影响几何?
那么,FDA的咨询委员会在FDA审批药物的监管过程中,扮演着怎样的角色?他们的建议对于FDA的决定产生多大的影响?在什么样的情况下,FDA会召集咨询委员会会议?药渡今天带你一探究竟!
何为FDA咨询委员会?
FDA咨询委员会(Advisory committees,简称Adcomm)是FDA负责牵头组建的,就人类和兽药、疫苗及其他生物制品、医疗器械和食品相关的问题,向FDA提供外部专家独立建议的临时机构。一般来说,FDA咨询委员会包括一名主席、几名成员,以及消费者代表、行业界代表各一名,有时还有一名患者代表。根据需要,可以为个别Adcomm会议增加具有特殊知识的其他专家。尽管委员会向FDA提供建议,但最终决定仍由FDA做出。也就是说,FDA可以做出与Adcomm相反的决定。
“内事不决问张昭,外事不决问周瑜”,FDA在很多类似Sarepta的基因疗法这样的审批项目拿不定主意时,就会依靠Adcomm来帮助他们根据现有科学做出正确的决定。咨询委员会会议可以涉及广泛的科学讨论,例如开发疫苗预防COVID-19。
专业知识、透明度和外部观点
FDA有49个技术及科学咨询委员会和小组,其中包括科学专家和公众成员。Adcomm成员是根据他们的专业知识来选择的,以满足每个特定Adcomm的职能和主题领域的需求。Adcomm成员具有广泛的背景分布,例如医师研究人员、统计学家、工程师、化学家和生物学家等。
此外,每个委员会通常包括一名消费者代表和一名行业代表。并根据会议主题,选择一名患者代表,为特定疾病或医疗产品提供患者或护理人员的经验。
FDA启用Adcomm的原因及意义:
从FDA外部的专家获得建议;
努力建设一个公开透明的政府机构;
鼓励患者、医疗保健提供者和其他感兴趣的人,在公开听证会期间提交评论来分享他们的观点。
委员会提供科学、医学建议
FDA咨询委员会的主要作用是在FDA评估产品时提供独立的专家建议,并帮助FDA根据现有科学做出合理的决定。
委员会审查和评估项目,以及FDA监管的任何产品的安全性、有效性和相关数据。人类和兽药、生物制品、医疗器械、烟草和食品有关的问题都包含在其中。例如是否批准药物、设备或更新现有产品的标签。除了具体的项目讨论之外,委员会也讨论一般政策问题。
Adcomm会议的过程是透明和独立的,并向公众开放。公众有机会向委员会发表言论,并分享他们的见解。在通常情况下,Adcomm会议会进行网络直播,以确保透明的讨论,并帮助公众了解FDA对产品和研究数据的期望。FDA通常在Adcomm会议召开前两个工作日向公众提供咨询委员会会议材料,这些材料包括来自FDA的议程和背景信息。
虽然Adcomm的讨论对于FDA的决策非常关键,但更关键的是,Adcomm的建议对于FDA不具约束力。虚心纳谏,并不意味着言听计从。FDA通常会遵循Adcomm的建议,但不受法律约束。最终的决策权仍然在FDA手中牢牢把握。
根据Milbank Quarterly上的一项统计研究发现,FDA对于大约80%的Adcomm的建议给予了支持,而对于20%则做出南辕北辙的决定。该研究调查了2008年至2015年间举行的376次AdComm会议,涉及298种产品或产品类别。该研究发现,FDA不遵循AdComm建议的主要因素,是AdComm成员本身就未能通过投票达成共识。那些票数微弱多数的观点,很有可能被FDA最终否决。换句话说,Elevidys的支持反对票数8:6,只是一个单次投票结果,可能并不具有统计学显著性。在这种情况下,FDA更有可能做出相对保守的决定,而不是微弱优势方代表的更激进冒险的观点。
为什么FDA只将某些药物
引向Adcomm?
在选择咨询Adcomm时,FDA是否有明确透明的标准来选择产品项目?这是目前争议比较大的一个话题。而且对于FDA为什么有时会批准Adcomm反对的药物,质疑声音也很大。例如,在2021年FDA对aducanumab进行了有争议的批准,但批准之前,Adcomm给出了压倒性的反对票。FDA如果能够开诚布公地列举出Adcomm投票项目的标准,会帮助制药行业更清楚地洞察他们的产品是否会在批准之前接受Adcomm的审查,以及准备听证会可能提出的问题。
值得注意的是,一份研究表明,2011年至2021年间,FDA将批准药物提交Adcomm审查的使用率从每年59%减少到6%,这是一个非常值得审视的信号,这更加引发了人们对FDA对于Adcomm选择标准的疑问。
研究对象包含482种新药和生物制品,其中114种药物(24%)在FDA批准之前由Adcomm审查。这个平均数由2011年的59%一路飞流直下地跌到2021年6%的水平。研究人员非常关注那些被Adcomm反对,但却被FDA批准的药物。他们表示,这类产品每年的中位数是1个。在接受Adcomm审查的这114款药物中,Adcomm对其中的104种药物(91%)投了赞成票,对10种药物(9%)投了反对票。
那些遭到Adcomm反对,但仍然被FDA“一意孤行”地通过的药物,包括2011年的罗氟司特(roflumilast)、2012年的florbetapir和omacetaxine mepesuccinate、2014 年的奥拉帕尼(olaparib)、2015年的帕比司他(panobinostat)和氟班色林(flibanserin)、2016年的eteplirsen、2019年的selinexor、2020年的oliceridine 和2021年的aducanumab。他们就像在足球比赛中起初被裁判宣判无效的进球,在经过VAR(视频助理裁判)审查后又失而复得被判有效的进球一样。对于反对票,Adcomm成员在讨论中最常见的顾虑是安全性和有效性(6 例)以及替代终点缺乏临床获益的证据(3例)。
关于Adcomm的争论
世异时移,FDA如今也在探索如何改革其咨询委员会,以确保这个组织能够充分发挥它们的作用。
从2010年到2021年,FDA举行了409次与人类药物相关的会议,但这些会议召开的频率在逐渐降低:从2012年的50次减少到2020年和2021年的18次。Adcomm会议频率的降低,主要表现在初步批准投票的委员会会议上,从2012年的26次降低到 2021年的8次。
有人的地方就存在争议。Adcomm的争议性在FDA加速批准Biogen的阿尔茨海默病药物Aduhelm(aducanumab)的事件上达到顶峰。当时Adcomm的几名成员一致投票反对Aduhelm的批准,但FDA最终并没有采纳投票决定,导致该小组成员辞职,以抗议FDA的一意孤行。
Aduhelm的后来者Leqembi(lecanemab, Eisai和Biogen的阿尔茨海默病药物)在7月7日得到了FDA的全面批准,虽然Adcomm委员一致通过,但也并非没有争议,因为委员会中仅有6名成员。
FDA在Leqembi的咨询委员会会议召开的最后一刻,增加了宾夕法尼亚州Abington Neurological Associates的神经学家David Weisman。他在过去的五年里,从Eisai和Biogen那里获得了数万美元,并直言不讳地表示支持Aduhelm。Weisman的入选使得Adcomm的公正性面临质疑。有人提出了建立生物伦理委员会,来审查Adcomm委员的资格,也有人甚至提出了废除Adcomm的建议。截至今年6月底,Adcomm在已经召开的19次Adcomm会议中,他们做出了18次批准药品的决定。
FDA认为保留Adcomm投票流程是有益的,因为投票结果对于FDA来说并不具备强制性的效果,而是为他们做出最终决定起到一个参考作用。尤其是当Adcomm委员会对某一申请一致性的投票结果,与FDA的决定产生分歧之时,后者需要十分审慎地对待。
如果FDA与Adcomm态度一致,FDA最终的决定也显得有理有据,增加了人们对监管结果的信任程度;如果FDA与Adcomm的态度出现分歧,也应该令公众了解实际情况,例如Aduhelm的评审。所以FDA认为,Adcomm策略是一种双赢的部署。
虽然咨询委员会的建议不会也不应该决定监管决策的结果,但生物制药行业大多认为咨询委员会成员,包括参与Adcomm会议的每个无投票权的行业代表,都是在严格的人类药物审查过程的重要组成部分。因此保留这个组织,尽管存在争议,仍然是必要的。
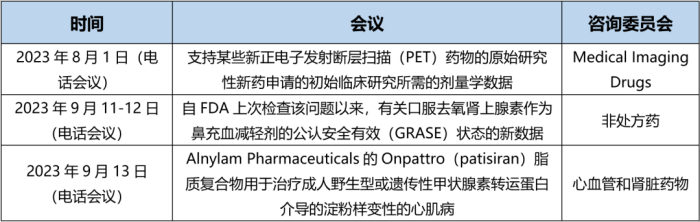
参考资料:
1. McKenzie, H. 9 Highly Anticipated FDA Decisions in the Second Half of 2023. Biospace. 29. 06. 2023.
1. Advisory Committees Give FDA Critical Advice and the Public a Voice. FDA.gov. 21. 09. 2021.
2. Craven, J. FDA's use of adcomms prior to drug approval decreased over the last decade. Regulatory Focus. 03. 05. 2022.
3. Dearment, A. FDA often goes against advisory committee recommendations when votes are divided, study finds. MedCityNews. 16. 06. 2019.
4. Recent And Upcoming FDA Advisory Committee Meetings. Pink Sheet. 07. 07. 2023.
5. Brennan, Z. No more FDA adcomm votes? Reforms brew as new research highlights decline in meetings. Endpoints News. 07. 07. 2023.
撰稿人 | 哥哈骎 药渡
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多