盘点:生物仿制药命名历史与规则

图片来源:Amjevitapro.com
简短来说,atto这个后缀区分了生物仿制药产品(即AmjevitaTM)和参考生物制剂(亦称参考产品,原研生物产品等,即Humira®)。Atto后缀提醒医师和使用者,此阿达木单抗非彼阿达木单抗,尽管从分子角度看是一样的,但是两款产品并不相同,不能像小分子原研药和仿制药之间那样划等号。
生物仿制药的命名规则,在过去的几年间发生了一些演变。在了解生物仿制药命名之前,有一个原则需要搞清楚,即生物仿制药不一定可以与参考产品(品牌生物制剂)互换。尽管两者之间不具备临床意义上的差异,但与小分子仿制药与原研药之间的关系不同,生物仿制药与品牌生物产品之间的关系并不一定是“可互换”(interchangeable)的。获取“可互换性”(interchangeability)的生物仿制药,只是这个团体中间的一小部分。
生物仿制药因为源自活细胞,因此尽管在分子结构上与参考产品相同,并且在临床效果上没有差异,但仍然可以存在诸如免疫原性等辅助作用上的差异。与小分子仿制药不同,生物仿制药在制造和稳定性方面与参考产品存在差异,就连不同的生物仿制药之间也存在不同。考虑到这些可能导致药物存在差异的因素,即便在活性物质名称的选择上,也需要将它们特别标注,避免药物选择上的错误,同时保证在跟踪记录药物不良反应的pharmacovigilance(药物警戒)中区分彼此。因此对于生物仿制药的命名,FDA规定了“核心名称(core name,指活性成分的分子名称)”加“四位字母后缀”的方式。注意,药物警戒是FDA强调的重点。
FDA 批准的第一个生物仿制药是艾滋病药物非格司亭(Filgrastim)产品 Zarxio®,该产品于 2015 年 3 月授权给Sandoz。当该产品获得批准时,它的命名采用了在非专有核心名称“非格司亭”后面缀上“sndz”这样的“占位符”,即Filgrastim-sndz。Sndz的词源非常明显,对应的就是Sandoz。当时对于生物仿制药的命名规定仍然在探讨之中。尽管针对Zarxio®的后缀名还有其它提议,但“-sndz”与《公共卫生服务法》第 351 节中的任何内容都不冲突, 符合美国 (USAN,United States Adopted Name) 指导原则的法案。其整个衍生名称Filgrastim-sndz在本质上仍然被认为是非专有的。
图片来源:Zarxio.com
但生物仿制药命名规则到了2016年就发生了变化。引发规则变化的生物仿制药是消炎药Remicade®(infliximab)的生物仿制药Inflectra,后者是原研生物产品Remicade® 的第一个生物仿制药,制药商为其指定了infliximab-dyyb的名称,其后缀dyyb看不出有任何指代意义。
图片来源:Vinmec
情况的变化来自于FDA在之前的2015年8月份发布的《生物制品的非专有命名》(Nonproprietary Naming of Biological Products)指南草案。
该指南指出,生物仿制药后缀应该符合以下条件:
· 有4个小写字母
· 独一无二
· 后缀产生了宣传暗示,例如在安全性或有效性方面做出虚假陈述(这与药物商品名的原则一致)
· 包括临床实践中常用的缩写,这可能导致后缀名被误解为处方或医嘱中的东西
· 包含由 USAN(United States Adopted Name)理事会指定的任何原料药名称或核心名称
· 与当前上市产品的名称相似
· 后缀应该是 4 个小写字母,其中至少 3 个不同
· 非专有
· 用连字符与其核心名称连接
· 除了将后缀附加到核心名称的连字符外,还包括数字和其他符号
· 类似于当前销售产品的名称
· 暗示许可证持有人的名称(例如Filgrastim-sndz中的sndz明显暗示了Sandoz)
这些附加要求的目的是防止后缀造成不必要的混淆,从而导致用药错误。这看上去是小事,但后缀与另一种药物名称造成的混淆所导致的用药错误,无论是给药途径还是给药间隔,抑或更大的错误,所造成的后果有可能是无法弥补的。这些要求还可以防止像“-sndz”这样的后缀用于产品命名。同样,只有 2 个不同字母的后缀,例如2016 年 8 月获批的依那西普(Etanercept)的生物仿制药Erelzi (etanercept-szzs)的后缀“-szzs”,也将扔入历史的故纸堆中。

新指南出台后的最初阶段,决策者决定将这些规则也应用于已经上市的生物仿制药,即Filgrastim-sndz这样已经正式使用的名称属于“私搭乱盖”,必须进行更改。但这个决定毫无争议地引发了争议。2019年3月,该“追溯”性要求被废止,已上市的不符合现行规定的生物仿制药名称得以保留。理由是,如同其它的任何更名一样,药品的更名可能会引发混乱,包括产品错误陈述和医疗保健系统的成本增加等,这与命名规则“正本清源”的目的背道而驰。因此FDA顺应民意地表示,对于已经产生的上市生物仿制药的命名“既往不咎”,但指南出台之后,所有的生物仿制药命名都必须遵守这些规则。不仅如此,FDA还要求Originator Biological Product(原研生物制品)也要遵守这些规则。例如2021年6月获批的治疗阿尔茨海默病的AduhelmTM (Aducanumab-avwa)、2023年3月批准的针对极其罕见的高胆固醇的幼儿患者的EvkeezaTM (Evinacumab-dgnb)、2020年批准的针对成人偏头痛的预防性治疗的VYEPTI™(eptinezumab-jjmr)等,这些原研生物制品的核心名称(core name)后都附带了连接符和四位后缀小写字母。
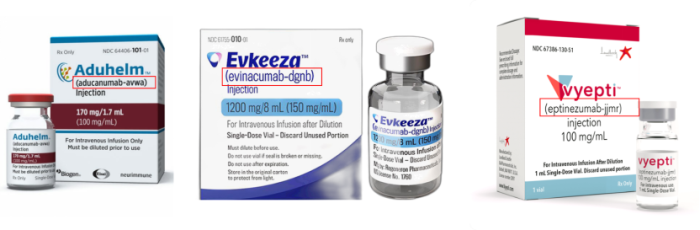
图片来源:FiercePharam, GoodRx, Vyepti.com

图片来源:Amjevitapro.com,wikimedia commons.
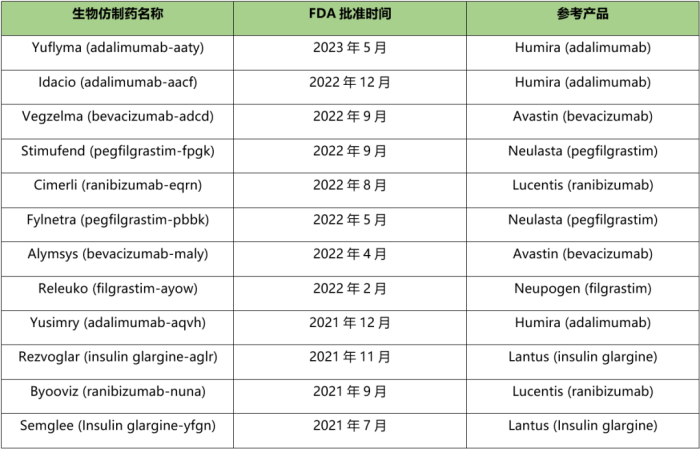
附表:2021-2023年5月FDA或FDA批准的生物仿制药
撰稿人 | 哥哈骎
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多