开发下一代抗体偶联药物(ADC)的关键考虑因素
业界对开发 ADC 的最佳方法的理解仍在不断发展。虽然这些靶向疗法现在可能正在逐步上市,但新形式已经进入临床管线,并有追赶的趋势。与更传统的 ADC 相比,新形式偶联物的优势是在靶点部位实现更大的选择性定位,从而提高有效载荷的治疗指数。这些方法包括将有效载荷与抗体和抗体替代品偶联或融合,作为靶向部分。
抗体具有出色的识别特性,这已被证明在免疫肿瘤治疗方法中至关重要。较新的形式,如肽、蛋白质支架和适体,提供类似的靶点识别,但经过专门设计,以允许“访问”新靶点、增加药物:抗体比 (DAR) 的控制并降低免疫原性,以提高药物开发的有效性。自第一个 ADC 获得批准以来,在 ADC 开发中吸取了许多经验教训,可以转化为下一波此类药物,还可以从抗体替代品的开发中吸取更多经验教训,以加快未来的进步,造福于患者。
在 ADC 开发中用抗体“亚型”补充靶点
为抗体治疗选择特定的抗体亚型对于确保最大的治疗活性和最小的副作用至关重要。抗肿瘤抗体药物通过几种不同、但不相互排斥的机制发挥治疗作用,包括(1)Fc 介导的效应器功能;(2)阻断肿瘤生长信号;(3)抑制血管生成;(4) 触发肿瘤细胞的凋亡途径;(5) 激活免疫细胞。
虽然根据靶点选择抗体亚型没有严格的标准,但应考虑靶点的细胞分布和生物学功能。IgG1 和 IgG2 亚型刺激 FcRγ 活性,导致抗体依赖性细胞毒性 (ADCC) 或抗体依赖性细胞吞噬作用 (ADPC)。相反,IgG4 是 FcγR 介导的效应器功能的不良诱导剂。选择合适的抗体可以创造出与正在治疗的疾病生物学相匹配的不同作用模式。
详细描述的 ADC 药物作用机制包括:(1) mAb 与肿瘤细胞中的靶点结合;(2)通过受体介导的内吞作用将ADC内化到细胞中;(3) 从内化的 ADC 释放细胞毒性有效载荷、以杀死靶细胞。虽然 ADC 的主要作用是通过输送到细胞的毒性有效载荷介导的,但 Fc 介导的功能也有助于它们发挥作用。
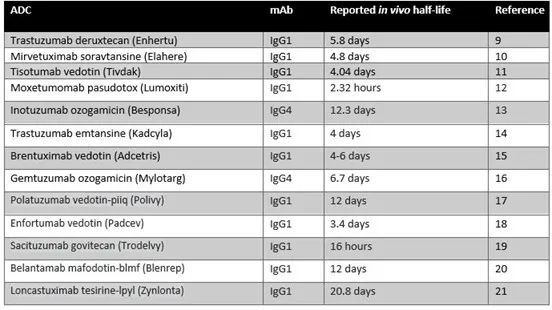
迄今为止,大多数 ADC 使用具有 FcγR 功能的 IgG1 抗体(表 1)。用于治疗 CD30 阳性淋巴瘤的Adcetris,由 brentuximab IgG1 和改良的 auristatin 有效载荷组成。报告显示,这种 ADC 可以通过其 FcγR 作用诱导 ADCP,从而有助于其有效的抗肿瘤作用。然而,一些研究已经确定 ADC 与 Fc 受体的结合是副作用的原因。Kadcyla 是一种用于治疗转移性乳腺癌的 ADC,由与细胞毒剂 DM1 共价连接的曲妥珠单抗组成,已被证明可通过 FcγRIIA 参与体内内化进入巨核细胞,导致血小板减少症。
在 ADC 的生产过程中,有效载荷偶联通常会增加抗体分子的疏水性,从而导致稳定性降低和聚体增加。已知 ADC 聚体会增强脱靶细胞毒性,但使用 FcγR 阻断抗体或 Fc 工程以沉默 Fc 介导的效应器功能有可能降低这种效应。因此,FcγRs 在 ADC 聚体的内化中起着重要作用,并增加了脱靶毒性的可能性。
在开发使用抗体替代品的新型 ADC 时,结合靶点生物学和配体功能方面的经验教训至关重要。抗体替代品,如双环小体、半胱氨酸蛋白和 Optimer 结合物,正在开发作为新型 ADC 的运载工具,它们不具有 Fc 区域,因此缺乏激活 Fc 介导功能的能力。对于许多 ADC 而言,这可能被视为一种好处,因为它有可能减少脱靶相互作用。然而,在 ADCC 和 ADPC 效应促进 ADC 活性时,FcγR 激活抗体仍然是 ADC 开发人员工具包的重要组成部分。
优化半衰期功能的形式
ADC 的药代动力学和药效学特性,例如它们的体内半衰期,部分取决于所使用的亲和配体形式。对于标准 IgG 抗体,IgG1、IgG2 和 IgG4 亚型在血清中的半衰期约为 21 天。对于 IgG3,这减少到大约 7 天。对于批准的 ADC,这些分子的平均半衰期在体内为 7 天(表 1)。这种稳定性允许这些药物在被消除之前循环足够的时间以到达它们的目标组织,并且提供比单独的细胞毒素更长的半衰期,由于分子量小,细胞毒素将通过肾脏过滤迅速清除。
虽然这种长半衰期被认为是可取的,克服了患者重复给药的需要,但挑战包括大分子量,这减少了毛细血管壁的外渗和扩散到实体瘤块中。由于大多数 ADC 是使用硫醇-马来酰亚胺化学制备的,它们可以经历药物连接子与抗体的解偶联,特别是对于含有马来酰亚胺己酰部分的连接子。在这些情况下,多达 50%-75% 的药物连接子在 7 天内在血浆中解偶联。解偶联药物连接子与含硫醇的血浆分子(如白蛋白)发生反应,可能通过增加有效载荷半衰期和脱靶效应而导致毒性。在 PinotBio,研究人员使用 Pinot-ADC 平台提供一系列与不同释放策略兼容的药物-连接子系统,包括允许在细胞内和肿瘤微环境内快速高效释放药物的 pH 敏感性连接子(图 1)。Pinot-ADC 还使用了一种新的有效载荷,这种有效载荷已被证明在单独给药时是安全的,即使在非人类灵长类动物毒理学研究中使用相对较高的剂量也是如此,并允许实现更宽的治疗窗口。PinotBio 正在开发这种药物-连接子系统,其中包括用于生成 ADC 的抗体和用于新型 ADC 的 Optimer 结合物中的新型亲和形式。Optimer 结合物是亲和配体,可用作有效载荷的运载工具。与抗体相比,它们的分子量为 15-30kDa,具有更小的分子尺寸,可潜在改善外渗和组织渗透。Optimer结合物是由 DNA 或 RNA 合成的亲和配体,允许调整分子半衰期,包括“hit-and-run”策略或更长的保留时间。
使用多样化的 MOA 递送下一代有效载荷
来自 Daichii-Sankyo 的 Enhertu 和来自 Gilead 的 Trodelvy 在拓扑异构酶 I 抑制剂有效载荷的递送方面显示出卓越的功效。虽然这些结果很有希望,但仍然存在对 ADC 提供的高毒性化疗药物产生耐药性的问题。对拓扑异构酶 I 的耐药性被假设归因于多种可能的机制,包括:
topo I 表达水平降低
topo I结构代谢酶突变
激活 NF-ĸB,抑制细胞凋亡
通过活性药物外排减少细胞内药物积累
在此之后,业界正在寻找在这些平台上推进的新方法。Pinot-ADC 中使用的 FL-118 有效载荷是一种新型的喜树碱衍生有效载荷,在抑制拓扑异构酶 I 方面与其它喜树碱类似物具有相当的性能。然而,FL-118 也能够选择性地抑制喜树碱多个成员的表达细胞凋亡家族和 Bcl-2 家族的抑制剂作为次要作用模式(图 1)。此外,由于 FL-118 绕过了由多种 ABC 转运蛋白外排蛋白诱导的耐药性,对于对伊立替康和拓扑替康等早期喜树碱产生耐药性的肿瘤,它仍然有效。
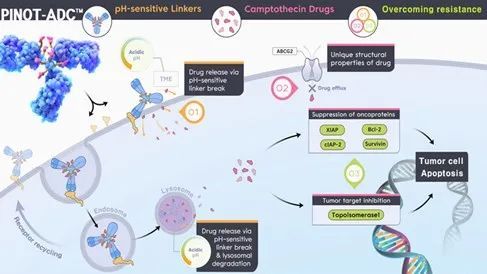
图 1:Pinot-ADC 利用多种作用机制帮助克服早期药物的耐药性,并采用新型连接子系统。
ADC 开始兑现用于肿瘤治疗的新型精准疗法的承诺。从 2017 年 ADC 的首次批准到今天不断扩大的管线,该行业一直致力于开发这些分子,并不断完善各个方面:靶点、靶向部分、连接子以及有效载荷。随着每一次进步,安全性和治疗效果都可以得到改善,但 ADC 开发的一个核心教训是,必须同时考虑分子的各个方面,以确保最佳性能。随着该领域的进步和更多的 ADC 被推向市场,进步正在逐步发生,重点是平衡每种疾病适应症的最佳技术,这将有望支持肿瘤患者治疗的改善和患者预后的改善。
原文:H.Y.Cho, B.S.Lee, Key Considerations For Developing Next-Generation Antibody-Drug Conjugates. Bioprocess Online, 2023.
本文节选自来自PinotBio, Inc.的研究人员发表的文章“Key Considerations For Developing Next-Generation Antibody-Drug Conjugates”,详细内容,请参考原文。
内容来源:生物工艺与技术
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多