浅谈创新药固体制剂开发中提高药物溶出度的方法

1. 辅料的选择——多选用一些性能更优的辅料提高药物的溶出度
制剂处方中辅料本身是惰性的,一般不会与药物发生化学相互作用,但是辅料可以对药物产生某种作用,以致会影响药物的溶出度,例如辅料会对药物产生一定吸附作用,或者辅料可以改变药物的表面活性等。对于疏水性药物,常常会更多的选择一些亲水性辅料,有利于改善疏水性药物的亲水性,使得水性介质更容易渗入片芯内部,从而促进崩解和溶出。常用的亲水性辅料作为填充剂的有淀粉、乳糖、甘露醇等,其中,乳糖的使用频率会更高一点,乳糖的型号有很多种,不同的型号具有不同的粉体学性质,可适用于不用的处方工艺,例如无水乳糖常用于干法制粒工艺;喷雾干燥乳糖例如FlowLac@100常用于粉末直压工艺。而且乳糖和微晶纤维素也号称辅料界的“金童玉女”,两者常常会搭配使用,乳糖在处方中可以发挥良好的流动性、一定的可压性以及释药速度快等优势,而微晶纤维素的可压性很好,同时它具有很强的吸水膨胀作用,可以促使水分快速进入片剂内部,使得片剂可快速崩解,将乳糖和微晶纤维素两者的优势作用结合起来,可以保证片剂的具有良好的可压性、可放大性以及保证片剂的快速溶出速率。
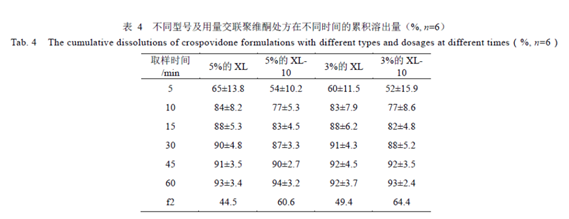
处方中粘合剂的种类及用量也会对片剂的崩解和溶出造成一定影响,常用的亲水性辅料作为粘合剂的辅料有:PVP、HPMC等, PVP是一种良好的片粘合剂,采用PVP作为粘合剂制得的颗粒表面具有亲水性,水性介质易润湿进入片芯内部,从而促进片剂的崩解和溶出;HPMC作为粘合剂具有良好的表面活性,可以降低药物的接触角,使得疏水性药物更易被润湿,从而提高药物的溶出度,例如有文献研究用HPMC作为粘合剂代替布洛芬原处方中的淀粉糊,可有效提高布洛芬的溶出度问题。
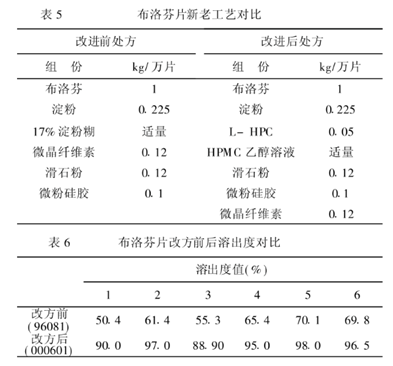
另外崩解剂在片剂处方中也发挥着重要作用。崩解剂会直接影响到片剂的崩解性能,从而影响药物的体内外溶出。CMS-Na、PVPP、CCNa、L-HPC等均是常用的一些性能优越的崩解剂种类。例如PVPP俗称“超级崩解剂”,崩解性能十分优越,常用的有XL、XL-10两种型号,不同型号的PVPP对不同药物片剂的崩解性能有所差异,例如有文献研究PVPP XL和XL-10对瑞舒伐他汀钙片溶出的影响,结果显示PVPP的型号及用量对处方溶出影响有一定差异,最终处方中优选了PVPP XL-10,用量在3%~5%。
2. 从药物本身的性质出发提高药物的溶出度

3. 从制剂工艺角度出发去提高药物的溶出度
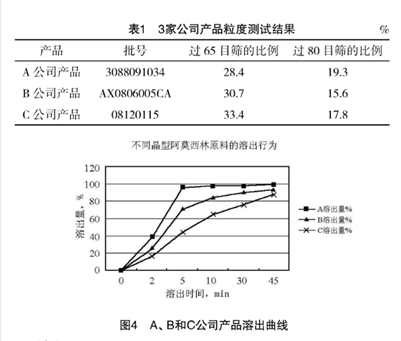
首先是原料的预处理工艺,对于疏水性药物而言,一般工艺制成的普通片剂可能存在体外溶出度低、溶出不完全以及体内生物利用度低等问题,因此需要对原料进行一定的处理,可以考虑将原料进行微粉化处理,以减小粒径而增大接触比表面积,从而提高体外溶出及体内生物利用度。另外原料经微粉化处理后,可以促使其与辅料的混合更加均匀,制备得到的片剂表面更加光滑细腻,含量更加均匀,使得片剂做溶出时的RSD更小、更均一。或者如果将原料微粉化处理 ,并不能很好的提高药物的溶解度和溶出速率,也可以考虑采用制剂手段将药物制成纳米晶制剂或者改变药物的晶体形态,制成无定形的固体分散体以提高药物的溶解度。
其次是制粒工艺,制粒工艺制得的颗粒的粒度、均匀度、流动性等均会对片剂的硬度、含量均匀度、重量差异等产生较大影响,从而影响片剂的溶出行为。例如湿法制粒过程中,粘合剂的加入方式和加入量会影响颗粒的润湿状态,如果粘合剂加入量过多,湿搅拌时间越长则粘性越大,导致制备得到的颗粒就越硬,会使片剂的可压性更差,崩解和溶出更慢。又例如在湿法制粒的流化床干燥过程中,如果制粒的风量控制不合理,风量过大或过小,也会影响颗粒的状态。因此,根据不同的品种,想要获得适宜的颗粒,还是要多注重生产过程中经验的积累,通过工艺验证获得适宜的工艺参数是非常有必要的。在压片前的最后一道总混工序中,润滑剂的用量和混合时间对片的溶出行为也有显著的影响,常用的润滑剂主要是硬脂酸镁,它属于疏水性物料,如果加入的量和混合时间设置不合理的话 ,其疏水作用会导致片剂的溶出度下降,因此加入的量和混合时间要做充分验证。
另外是压片、包衣工序,压片机的压力越大,片剂的比表面积、孔隙率就会减小,水性介质进入片芯内部的速度就会变慢,从而导致片崩解和溶出更慢,而且压片压力和颗粒本身的状态有很大关系,如果制备得到的颗粒状态较差,比如太硬了,那在压片过程想要获得目标硬度的压力,势必就需要更大的压力,因此还是需要先从制粒工序中做优化,其次就是在压片过程中需要根据不同的冲模选择适宜的压力(硬度)范围。
4. 从环境因素角度出发提高药物的溶出度
有些药物分子对光、热、湿度等不稳定,例如多晶型的药物,可能遇到高温、或者在高湿的环境下会存在转晶行为,从而导致药物的溶解度下降,又例如有些药物遇光会分解、有些药物与包材接触会发生某种降解等等,最终也会导致溶出受影响。虽然在项目开发的早期,我们会做一系列的原辅料相容性或者影响因素试验来对制剂的处方、工艺、乃至包材的选择提供必要的数据支持,但是有些品种,可能只有在长时间的稳定性研究过程中才会被发现,比如有些品种本身遇水就会发粘,那在加速试验的条件下,随着留样时间的延长,片剂吸潮会导致原料在片剂内部发生聚集行为,在溶出过程中就会存在片剂崩散不完全,溶出变慢。
如果片处方中应用的是一些吸湿性较强的辅料,比如选用乳糖作为填充剂、CCNa作为崩解剂时,在高湿条件下乳糖会部分溶解并在片剂内部形成一定孔隙 ,CCNa遇水会迅速吸水膨胀(吸水后膨胀倍数小)并填充于乳糖溶解产生的孔隙内,其崩解力变弱,最终导致片剂的崩解和溶出变慢。综上,以上种种案例均提示我们,要从处方本身出发,来分析可能影响片剂溶出的外界环境影响因素,如果处方中应用了吸湿性较强的辅料或者原料本身遇湿易发粘,那片剂的贮存条件就要考虑尽量在湿度较低的环境下;如果多晶型药物遇热、湿易转晶,那贮存条件就要尽量避免高温和高湿等。
参考文献:
[1] 药剂学第七版[M]人民卫生出版社
[2]丹玉华,羟丙基甲基纤维素(HPMC)在片剂生产中的应用[J]齐鲁药事,2004,23(2),56-57
[3]何华等,处方中的辅料对瑞舒伐他汀钙片溶出的影响[J]中国医院药学杂志
[4] 陈格等,不同晶型阿莫西林原料对制剂溶出行为的影响[J]综合医学,2013,11(13):136-137
内容来源:药事纵横
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多