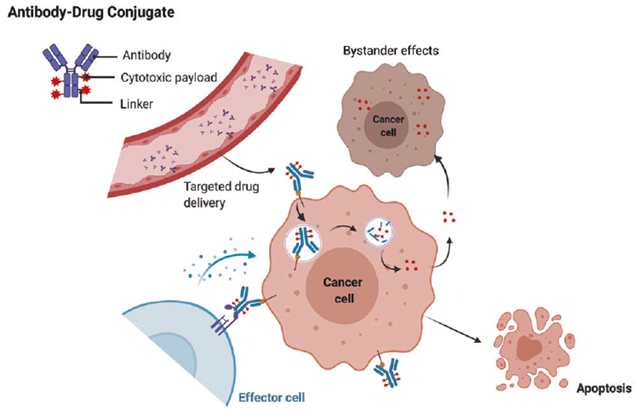
图1. ADC通过不同途径杀伤癌细胞的机制概述[1]
抗体偶联药物(Antibody-drug conjugates, ADC)是一类针对癌症的生物治疗药物,它结合了单克隆抗体(mAb)的靶向能力和细胞毒性药物(Payload,有效载荷)的抗癌能力。抗体和有效载荷通过连接子(Linker)进行连接,允许将特定药物递送至抗体靶向的癌细胞。ADC进入细胞后,连接的有效载荷被释放并杀死细胞(图1)。
虽然ADC旨在靶向并杀死肿瘤细胞,同时不伤害健康细胞,但第一代ADC平台存在一些局限性,导致ADC的治疗窗狭窄且对患者具有不可接受的毒性。 针对上述问题,本专题系列将总结归纳国内外知名企业应用的ADC技术平台。
作者|西山含黛
Synaffix公司成立于2010年,是一家拥有临床阶段平台技术的生物技术公司,可在技术外包业务模式下提供一流的ADC、双特异性抗体和其他靶向治疗药物。目前该公司的平台技术包括GlycoConnect™,HydraSpace™和toxSYN™ Linker-Payloads[2]。
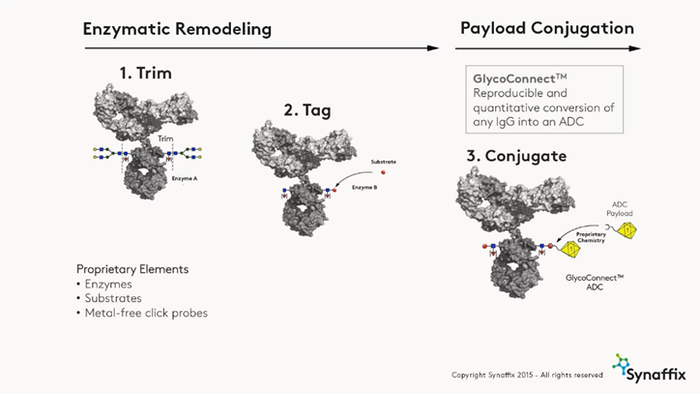
图2. 基于GlycoConnect™技术构建ADC[3]
GlycoConnect™技术是一种稳健的、普遍适用的非遗传技术,对天然(非工程化)mAb中高度保守的N-糖基化位点(Asn-297)进行改造。利用工程化的内切糖苷酶和天然糖基转移酶实现高效的一锅式聚糖重塑,并结合新型糖底物6-叠氮基-GalNAc;通过无金属催化的点击化学生成稳定且位点特异性的ADC,保证ADC具有更高的治疗指数(图2)。该技术适用于任何IgG亚型,无论其糖基化如何[4]。将GlycoConnect™与HydraSpace™极性间隔技术相结合的ADC的治疗潜力与Kadcyla® (ado-trastuzumab emtansine)相比,疗效和耐受性得到明显提升[5]。GlycoConnectTM技术可以进行药物抗体比(Drug-Antibody ratio,DAR)调整,制备DAR值为1、2、4或6的ADC,而无需修改抗体序列[6]。此外,根据肿瘤生物学利用toxSYN™技术提供多种连接子-有效载荷的选择,从而最大限度地提高疗效。
目前,利用GlycoConnect™技术平台构建产生的ADC已进入临床实验[7],对其疗效进行评估(表1)。
通过将GlycoConnect™与该公司的其他互补技术相结合,Synaffix整合了专有的一流的ADC以及双特异性抗体所需的必要技术。凭借其临床阶段平台技术,Synaffix已成为首选技术提供商,可实现一流的靶向癌症治疗。目前,该技术平台授权/合作于ADC Therapeutics,Mersana Therapeutics,Janssen,Shanghai Miracogen Inc.,Innovent,AMGen,GenMab,ProfoundBio,MacroGenics等公司[8]。

ThioLogics公司开发了一个突破性的位点特异性偶联平台,允许对蛋白质和肽中的二硫键或游离半胱氨酸进行选择性、稳定的功能性修饰。该技术能够对蛋白质进行多种修饰以产生明确的同质产品,因此其治疗指数比类似的异质制剂有很大提高;同时,同质性也将大大简化工艺和开发问题,从而降低生产成本。ThioLogics偶联平台在生物制品领域的体现包括:(i)肽和蛋白质制剂,(ii)创造稳定且易于生产的双特异性抗体,以及(iii)为全抗体和抗体片段开发稳定且均质的抗体-药物偶联物。
在本部分中,我将重点介绍ThioLogics公司的二硫键桥接技术(Disulfide Bridging Chemistry)。通过化学方法重新桥连抗体链间二硫键,并在每个重新桥接的二硫键上产生单点功能化位点,引入有效载荷。与现有的生物偶联方法相比,这种化学具有显着优势:高效快速,确保敏感二硫化物的快速功能化;适用于一系列复杂的蛋白质—全抗体、抗体片段、蛋白质和肽;偶联物能够保留生物活性并且在体内耐受性良好;完全可调偶联,使DAR值为1、2、3或4[9]。
除对二硫键进行单功能化外,该平台技术的亮点是其还可进行二硫键双功能化[10]。该技术的核心是基于带有正交反应性“手柄”的二溴哒嗪二酮(diBrPD)插入抗体片段或完整抗体的天然二硫键中,以期进行两个正交转化以产生多功能加合物(图3),能够以高度收敛的方式快速组装双修饰的ADC。由此产生的结构非常稳定,即使在高温条件下也不易水解。除ADC领域外,该种“即插即用”的构建方法也可有更广泛的应用。
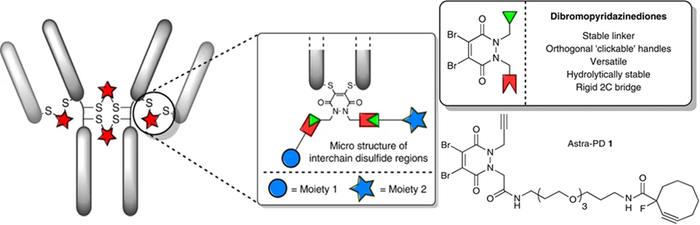
图3. 通过哒嗪二酮结构进行的二硫化物重桥接产生具有双重模式的位点选择性修饰抗体[10]
该技术多用于科学基础研究,其合作/专利授权使用信息基本上没有。该公司于2015年后未再维护官方网站。
Concortis Biotherapeutics
除ThioLogics公司涉及二硫键桥接技术外[11],Concortis Biotherapeutics也涉及该部分的内容,称其为C-Lock™偶联技术(图4)[12]。该技术与传统的巯基-马来酰亚胺偶联技术相比拥有诸多优点。
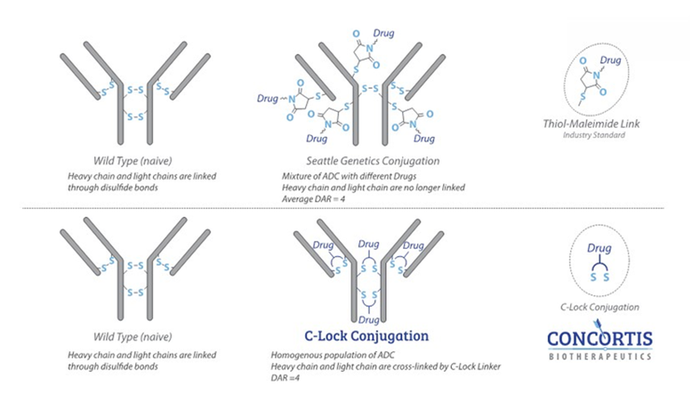
图4. 半胱氨酸的传统修饰方法与C-Lock™偶联技术的对比
利用专有的C-Lock™偶联方法利用新型化学接头(喹喔啉,Quinoxaline)在链间二硫键还原后重新连接抗体重链和轻链[13]。交联后为每个二硫键引入一个有效载荷。所得ADC在体外和体内具有增强的稳定性,并可能改善PK和PD曲线。通过优化交联缀合过程,大量生产具有DAR 4的ADC,从而简化ADC生产中的纯化和表征过程。
位点特异性偶联可以消除异质性、提高偶联稳定性并增加治疗窗。除拥有的C-Lock™技术可以实现这方面的要求外,该公司还开发了K-Lock™技术[14],该方法是一种接头控制的位点选择性偶联技术,针对抗体中存在的80-90个赖氨酸(Lys)中的2个天然Lys位点进行偶联,无需利用细胞工程或酶促反应对抗体进行修饰。生成的ADC具有较少的区域异构体和较低的DAR值,同时保持与标准缀合方法生成的ADC相当的效力。
Concortis Biotherapeutics利用自己平台技术构建的ZV203 (anti-HER2, gastric/breast cancer)和STI-0602 (anti-cMet, NSCLC)目前均未有临床试验记录。一方面可能是公司重组拆分的商业化考虑(2012被收购,2015拆分),另一方面也可能是该种方法自身存在的缺点(链间错配等)有关。
荣昌生物
除上述两家公司开发的特定连接子的链间半胱氨酸(Cys)桥接偶联技术外,荣昌生物制药(烟台)有限公司开发出以三丙烯基三嗪类(Triallyl triazines, TaTa)桥接连接子技术[15]。在还原条件下,打开IgG1的链间二硫键,裸露的巯基与丙烯酰基发生迈克尔加成反应,通过重塑链间二硫键引入有效载荷。利用该技术构建的Zapadcine-1靶向DR5受体蛋白,在体外和体内对白血病和实体肿瘤具有很好的抗肿瘤增殖活性[16]。此外,该桥接(Thiel-bridge)偶联技术平台[17]已经成功应用于RC88。
针对专利和文献中提及ADC,我们将其与荣昌生物的明星产品-维迪西妥单抗(爱地希®,RC48)[18, 19]进行简单的对比(表2)。
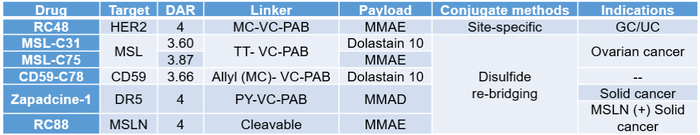
RC48在多种缺乏有效治疗手段的晚期癌症中展现出强大的抗肿瘤效果。基于此,2021年8月8日,荣昌生物与国际知名生物制药企业-西雅图基因(Seagen Inc.)达成一项全球独家许可协议,以开发和商业化其ADC新药RC48[20]。从世纪初国内创新药刚起步,受到企业经验和能力的限制以及快速补充管线促进融资的需求,国内市场上多是看到从海外药企License in的产品,此次荣昌生物的开展License-out项目为国内创新药走向国际市场增强信心;同时,也使其专有桥接(Thiel-bridge)偶联技术平台[17]走上更高的舞台。
荣昌生物作为国内ADC药物研发龙头企业,公司依托此平台建立了丰富的ADC研发管线。除了上市的RC48和前面提及的RC88,还有靶向c-MET的RC108、靶向Caudin18.2的RC118均处于临床研究阶段(表3)[7];用于治疗多种实体瘤的RC168、RC178和RC188处于IND申报阶段。
表3. 荣昌生物进入临床实验的ADC信息汇总[21]


Accelerating ADC Innovation
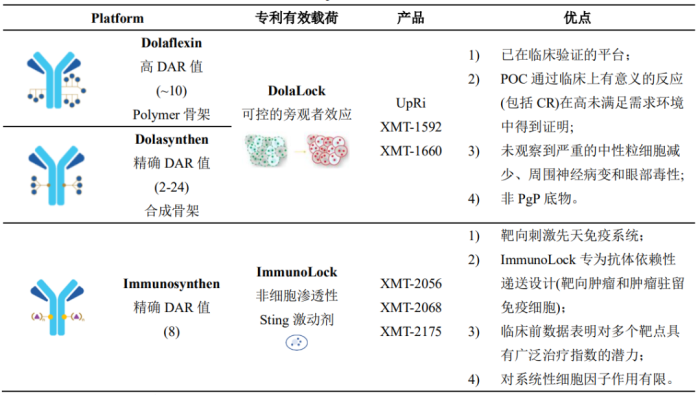
Mersana Therapeutics公司专门从事ADC疗法的研发,造福癌症患者。该公司利用数十年的行业经验,开发出专有且高度差异化的ADC平台技术:DolaLock Technology,Dolaflexin,Dolasynthen和Immunosynthen (表1)[2, 3]。利用以上平台技术快速设计和测试新型ADC并确定具有最佳功效、安全性和耐受性的ADC。
表4. Mersana Therapeutics ADC 平台技术概览
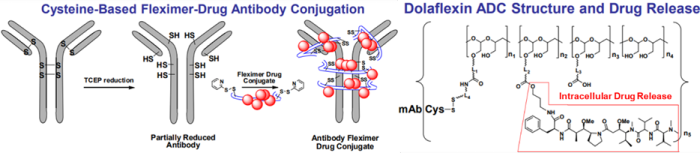
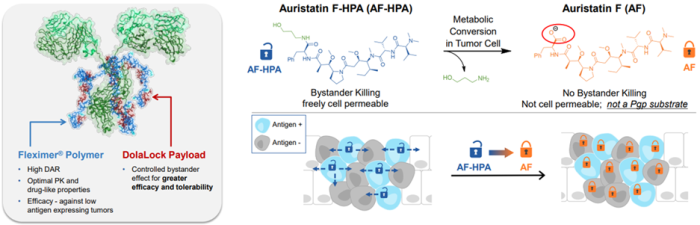
Dolaflexin平台基于新型可生物降解聚缩醛聚合物(Fleximer®)的共轭系统构建的新一代ADC,克服了传统ADC药物的局限性(DAR值较低)。Fleximer®聚合物(poly(1-hydroxymethylethylene hydroxymethylformal, PHF)是一种可生物降解、高度生物相容的水溶性聚合物,携带多种药物分子[4-6]。药物分子不是直接与抗体偶联,而是通过优化的可裂解接头连接到Fleximer®支架,控制药物释放的机制和速率;然后通过不可裂解的接头与抗体偶联(图1, 图2左)[7]。Fleximer®显着提高药物溶解度,改善药代动力学参数和降低免疫原性,并显著增加ADC携带的药物分子数量(10-12)。
Dolaflexin平台技术构建的ADC具有诸多优点[4]:1)装有该公司专有的Auristatin细胞毒药物-一种高效的抗微管蛋白药物,属于DolaLock有效载荷,对快速分裂的细胞有选择性的毒性,可以控制旁观者效应;2)可以实现更高的DAR值或每个抗体的有效负载(>15)[8],从而在保持药代动力学和类药特性的同时提高疗效;3)在传统ADC无效的情况下,Dolaflexin ADC对抗原表达水平较低的肿瘤靶标也具有疗效[9]。Mersana Therapeutics凭借该技术在第七届世界ADC大会上获得“最佳ADC平台技术”奖[10]。
Dolaflexin平台技术的成功应用得益于DolaLock有效载荷[11]的加持,使其旁观者效应得以控制。旁观者效应(By-stander effect)[12]是指ADC将其细胞毒性有效载荷释放到目标细胞中,药物穿过细胞膜进入并可能杀死邻近的细胞,无论这些细胞是否癌变。旁观者效应是一把“双刃剑”,当旁观者为癌细胞时这种作用是有利的,但如果细胞毒性药物进入邻近的健康细胞则是有害的。
图6. Dolaflexin平台构建的ADC (左);DolaLock技术作用原理(右)[13]
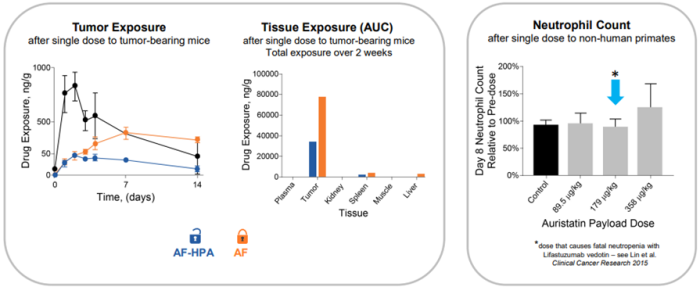
DolaLock有效载荷(Auristatin细胞毒性药物,AF-HPA)可在短时间内扩散到整个肿瘤中,其被代谢成一种仍然非常有效但不能穿过细胞膜的形式(AF),有效地将药物锁定在细胞内,控制旁观者效应(图2);同时可延长细胞毒性药物在肿瘤中的暴露时间并提高耐受性(图3),实现更安全、更有效的癌症治疗[13]。此外,该技术可以降低肿瘤的多药耐药性,DolaLock有效载荷不能被PgP (P-糖蛋白,药物输出泵蛋白,P-glycoprotein)泵出,避免癌症耐药的产生[11, 14]。
图7. DolaLock可延长肿瘤暴露时间并提高耐受性
专有的Auristatin有效载荷(AF-HPA)也在临床前测试中显示其可导致免疫原性细胞死亡,并通过树突状细胞激活来刺激免疫系统[15]。因此,已在临床前模型中观察到与免疫肿瘤药物(如PD-1抑制剂)的协同作用[16]。利用Dolaflexin平台技术构建的ADC XMT-1522和XMT-1536已进入临床试验。
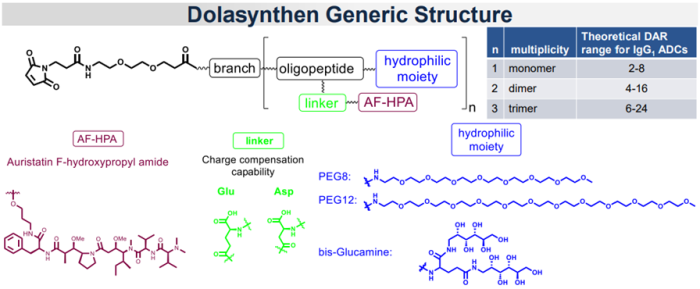
基于临床验证的DolaLock和Dolaflexin平台技术,Mersana Therapeutics经过优化开发了Dolasynthen平台技术,是一种新颖的、专有的、均质的有效载荷平台,能够构建DAR范围为2-24的ADC (图4)[17-19]。该技术共进行了三个阶段的优化:1)支架优化;2)偶联技术优化;3)抗体亚型及靶点的普适性研究[20]。
图8. Dolasynthen平台技术[17]
通过技术优化,Dolasynthen平台技术展现出诸多优势[18]:a) ADC的构建方法并非一刀切,最佳DAR会因不同的靶点和抗原而异,Dolasynthen能够精确调控DAR值(2-24),从而能够针对特定抗原和抗体优化DAR;b)可实现位点特异性生物偶联,减少偶联位点对ADC整体特性的影响,从而进一步优化ADC活性;c)该平台开发的ADC是均质的,每次都能向癌细胞提供一致和精确的药物输送,降低生产成本;d)其亲水部分的精确优化可以增加水溶性和增强PK特性;e) Dolasynthen平台技术结合自身的DolaLock有效载荷,具有控制旁观者效应的优势。
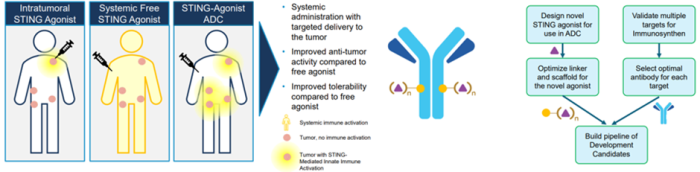
除上述三种技术平台外,Mersana Therapeutics还针对Sting激动剂开发了专有的平台技术-Immunosynthen (图5)[21-25],利用该技术所构建的ADC在肿瘤驻留免疫细胞和抗原表达细胞中局部激活Sting信号,利用先天免疫系统的抗肿瘤能力治疗癌症。Immunosynthen ADC的成功构建有可能解决当前激活先天免疫/Sting方法的局限性(疗效、靶向递送和耐药性等)[26]。
图9. Immunosynthen ADC的构建方法[24]
Immunosynthen平台技术利用ADC具有全身给药的便利性,提供专门针对肿瘤(包括转移性病变)的靶向递送;Sting激动剂与靶点的结合在全身循环中得到保护,最大限度地减少脱靶效应,改进其治疗指数;该类ADC通过内化方式进行主动摄取,可以克服游离Sting激动剂的PK和渗透性问题,从而持续激活先天免疫反应;此外,该方法构建的ADC靶向依赖性地递送至肿瘤细胞和肿瘤驻留免疫细胞导致两种细胞类型的先天免疫激活,产生有效和强大的抗肿瘤反应,同时也产生免疫记忆[22]。
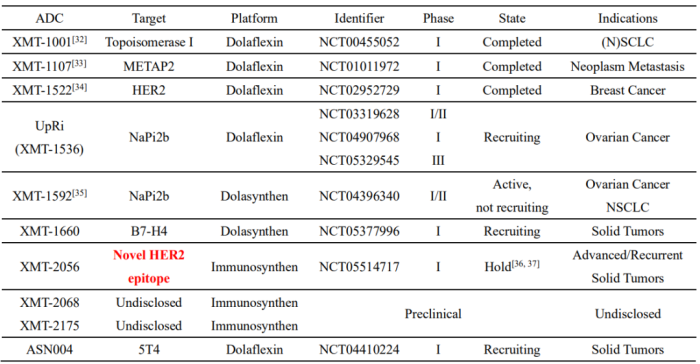
得益于自研的创新型ADC平台技术,Mersana Therapeutics能够为其自身以及合作伙伴建立一个强大的ADC研发管线[27]。Mersana Therapeutics主要候选药物包括Upifitamab Rilsodotin (UpRi)[28, 29]、XMT-1660[30]、XMT-2056[31]、XMT-2068、XMT-2175等(表2)。
表4. Mersana Therapeutics ADC平台技术研发管线信息汇总
Mersana Therapeutics的主要候选药物UpRi是一种靶向NaPi2b的first-in-class的Dolaflexin ADC,目前正在进行三项临床研究(表2):1) UPLIFT,一项针对铂类耐药卵巢癌患者的单臂注册试验[38];2) UPGRADE,一项评估UpRi联合卡铂的Ⅰ期试验[39];3) UP-NEXT,UpRi作为铂类双药治疗复发性铂敏感卵巢癌后单药维持治疗的Ⅲ期临床试验[40]。
Mersana Therapeutics和GSK已开展全球合作,为GSK提供共同开发和商业化XMT-2056的独家选择。但今年3月中旬,XMT-2056在I期临床中出现与治疗相关的5级(致命)严重不良事件,被FDA按下暂停键[36, 41]。此外,2022年11月,FDA要求Blenrep撤市,因该产品的验证性试验DREAMM-3未达到PFS主要终点[42]。除Blenrep和XMT-2056外,目前GSK公司ADC管线产品的开发模块较为薄弱。
除GSK外,Merck KGaA,Janssen Biotech和Asana BioSciences等企业正在使用Mersana Therapeutics的平台技术来推进他们自己的ADC管线研发。其中Asana BioSciences利用Mersana Therapeutics平台技术开发的靶向5T4靶点的ADC也进入临床Ⅰ期实验(ASN004,表2)[43-45]。
Mersana Therapeutics正在利用其专有技术平台建立强大的ADC研发管线,致力于显着改善癌症患者的生活,希望其能推出更多的造福患者的新型候选药物。
内容来源:医药速览 BiG生物创新社
责任编辑:胡静 审核人:何发

























评论
加载更多