收藏|生物药CMC研发进展浅谈
关键词
单克隆抗体药物;CAR-T细胞治疗药物;封闭系统;定点整合技术;LandingPad;Beacon单细胞光导系统筛选法;灌注培养工艺;灌注与流加结合培养工艺;连续工艺;在线实时监测技术;大规模生产技术;一次性技术。

生物药物的发展离不开生物技术的发展,1953年,沃森和克里克发现了DNA双螺旋的结构,开启了分子生物学时代,使遗传的研究深入到分子层次,“生命之谜”被打开,人们清楚地了解遗传信息的构成和传递的途径。上个世纪80年代,美国生物药进入产业化时代。1982年,美国礼来公司上市了世界上第一支重组人胰岛素“优泌林”,具有划时代意义。1986年,世界上首个单克隆抗体药物-抗CD3单抗OKT3获得美国食品和药物管理局(FDA)的上市批准,单克隆抗体药物产业化从此拉开序幕。而中国,首个重组人胰岛素(通化东宝公司)被CFDA批准上市是在1998年,生物药进入产业化时间比美国晚了16年。另外,从国内外首个生物技术公司IPO时间看,美国基因泰克公司IPO是1980年,而中国三生国健(原来是中信国健)公司商业化IPO是2007年,整整晚了27年时间。这些反映出中国国内生物制药发展差不多比美国晚接近30年,起步晚了很多。
值得庆幸的是,细胞治疗领域,尤其CAR-T细胞治疗,国内外研发与产业化进展比较接近。2017年8月,美国首个CAR-T细胞治疗药物Kymriah被FDA批准上市,标准着拉开CAR-T细胞治疗药物进入产业化序幕。2017年12月11日国家 CDE 官网的第一个 CAR-T 疗法临床试验受理的公开信息,标志着中国细胞疗法上市的帷幕已经揭开。希望中国CAR-T细胞治疗药物尽快进入上市,造福中国老百姓。目前,CAR-T细胞治疗药物走在前面的都是个体化CAR-T,产业化质量稳定性和一致性难以控制,而且成本昂贵,所以通用CAR-T细胞治疗是发展趋势。
下表是将中国生物制药归纳三个阶段:2014年以前归为初始阶段,主要以仿制为主,不注重创新;2014-2016年归为第二阶段,可以理解为转折点,由生物类似药为主转为提倡创新,注重专利保护;2016以后归为最后阶段,创新为主,更加关注全球专利保护,走出国门,与美国生物药市场接轨,尤其中美双报,进入国际市场。


1. 生物药单克隆抗体市场情况
这 10 年的年均增长率达31.65%,2015 年全球抗体药物销售总额达 916.3 亿美元, 2015 年阿达木单抗以 140.12 亿美元的销售额蝉联全球抗体排行榜第一位,也是全球药物排行榜的第一位,从2013 年开始阿达木单抗的销售额就已经超过100 亿美元,是迄今为止全球唯一一个销售额超过100亿美元的产品。2018年阿达木单抗销售额为199.36亿美元,逼近200亿美元。
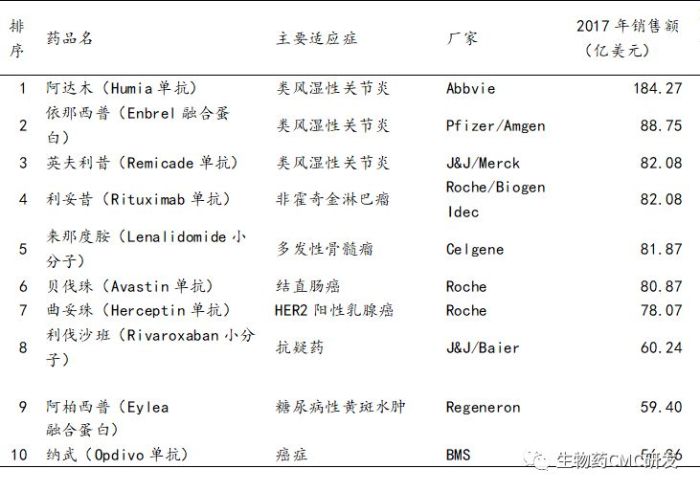
下表是NMPA(原CFAD)官方报道2017年全球最畅销的10个药物销售额统计,其中6个都是单抗药物,2个是融合蛋白药物,由此可见单抗药物的优势和发展前景。尤其是在自身免疫疾病和抗肿瘤领域,单克隆抗体药物相比小分子药物具有特异性强、不良反应小等临床优势。其中PD-1单抗Opdivo药物正在追赶,在2018年销售额为75.67亿美元,较2017年增长31.3%。
2017年全球最畅销的10个药物销售额
2. 生物单克隆抗体药开发流程简介
药物开发主要流程为:靶点确定、discovery、临床前药学研究(IND)、临床实验(临床I、II、III期)、NDA/BLA、上市,见下流程图。
推荐阅读:生物药物开发全流程
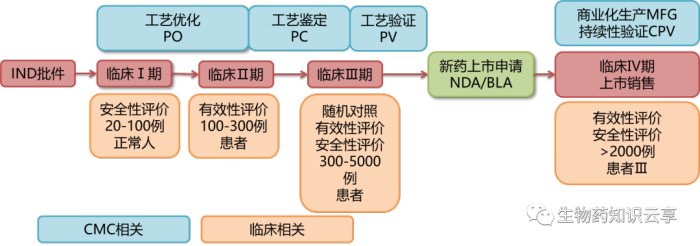
图 药物开发主要流程
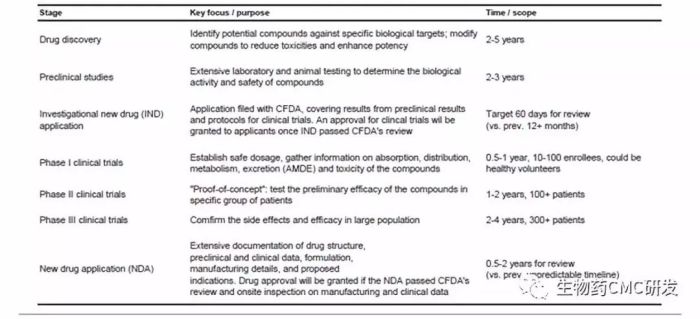
但实际上,每个阶段都是需要大量的工作与时间积累,才能走向最终上市,下表是将药物开发每个阶段关键点与时间表进行了汇总。其中discovery时间可能花的时间2-5年,笔者认为此部分工作花的时间与工作量,是非常之关键,因为它决定了后续模块的成败与速度,所以很多做药物开发的工作者,宁愿在discovery阶段将工作做得扎实详细。
 CMC(Chemical Manufacturing and Control),名词是沿用化学制药领域专有名词,也适用于生物制药,主要是生产工艺、杂质研究、质量研究,稳定性研究等药学研究资料,是药品申报资料中非常重要的部分,它是discovery与临床之间非常重要的环节,也是药品上市重要组成部分。
CMC(Chemical Manufacturing and Control),名词是沿用化学制药领域专有名词,也适用于生物制药,主要是生产工艺、杂质研究、质量研究,稳定性研究等药学研究资料,是药品申报资料中非常重要的部分,它是discovery与临床之间非常重要的环节,也是药品上市重要组成部分。
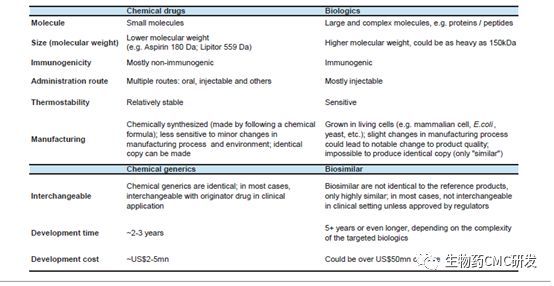
下表是化学制药与生物制药CMC领域对比,相对于化学制药CMC开发难度,生物制药更加难,因为生物药主要是由活的细胞或生物表达蛋白类大分子,蛋白的空间结构、翻译后修饰、稳定性等比化药复杂,工艺更加难以控制,所以在生物制药领域CMC需要结合生物技术的发展,不断提升CMC水平。
3.1 细胞株开发
细胞株是单克隆抗体药物CMC非常重要的一个模块,细胞株的好坏,直接决定工艺开发的难度与药物质量好否,甚至决定后续放大生产的成败与速度。下面简单谈谈细胞株开发的几个关键点:
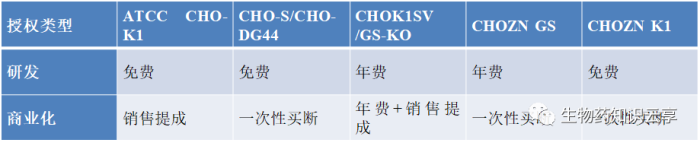
1)宿主细胞和Select Marker体系选择。CHO宿主细胞种类主要有:DG44、CHO K1、CHO-S、CHOK1SV(lonza公司2002年)和CHOK1SV GS-KO(Lonza公司2012年)、CHO-K1Q(康晟)、CHOZN/CHO K1(Merk公司(原SAFC)2006年)、Horizon Discovery CHO-K1HD-BioP3(Horizon公司)等。其中Lonaza、Merk、Horizon公司的GS缺陷型宿主细胞,在克隆筛选阶段会缩短一定时间,但收费都较为昂贵;Thermo(原Life technologies)公司的CHO-S宿主细胞,在生长最高密度具有较大优势,Fed-batch培养基最高密度达到30×106 cells/ml以上,同时细胞培增时间在17-20小时范围,对于细胞工艺开发和放大,CHO-S宿主细胞是不错的选择。由于GS体系表达量较DHFR体系高,以及在细胞培养工艺以及放大过程中无需添加Glutamine或GlutaMax,能够避免谷氨酰胺分解造成培养体系中氨水平高的问题,降低工艺控制难度,可有效提高细胞密度和延长细胞生存时间,同时也节省Glutamine或GlutaMax试剂费用。
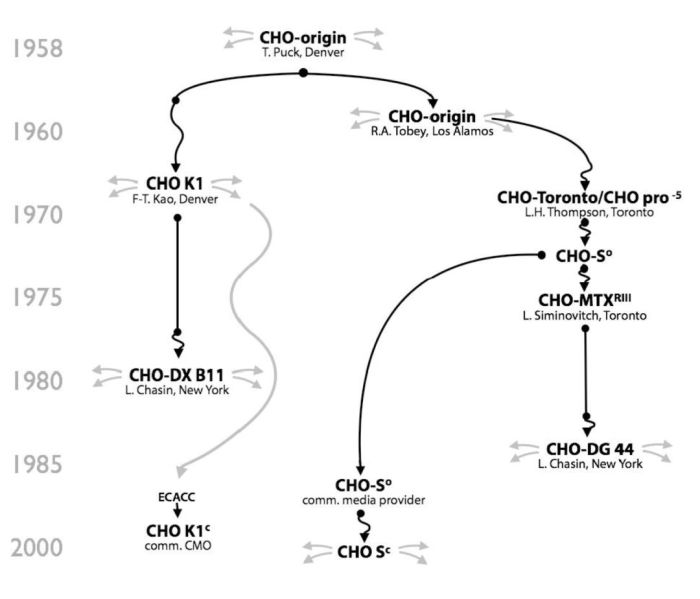
图 CHO发展历程
研发阶段很多细胞株可以免费试用,商业化生产阶段,均需要支付商业化生产许可费用。
2)表达载体构建。CHO细胞表达载体,主要在启动子、密码子会进行优化工作,如果是设计单个载体系统,即将轻链、重链插入一个载体中,在启动子方面可能会有差异,一般重链的启动子比轻链的启动子要强。当然商业化的表达载体,目前使用较多的是Thermo(原Life technologies)公司的Freedom pCHO1.0载体,它是单个载体系统,基本与CHO-S宿主细胞配套,一般细胞株可以做到3.0 g/L。
3)单克隆筛选技术。目前随着科技的发展,有传统的有限稀释法、流式细胞仪法、Clone Pix system筛选法、Single Cell Printer(Cytena)、Beacon单细胞光导系统筛选法。当然还有单克隆影像学拍照仪器,如:MolecularDevices公司的CSI(Cell SelectImager)仪器、Solentim公司的Cell Metric或Cell Metric CLD等。仪器越来越高效、越来越智能化。尤其一些新技术,国内引进比较晚,例如Single Cell Printer(Cytena)、Beacon单细胞光导系统筛选法两个方法,国内企业陆续采用。SingleCell Printer分选细胞较流式细胞仪对细胞的损伤要小很多,由于流式细胞仪的鞘液压力较大,以及电场的影响,导致细胞分选过程受损。Beacon单细胞光导系统是集抗体研发和细胞株构建一体的仪器,最大的优点可以快速检测单个细胞表达量以及细胞株的稳定性。
4)定点整合技术。目前工业上主要是外源基因随机整合到宿主细胞基因组中,通常需要多轮克隆筛选才能产生可接受的高表达克隆,但每当构建新的表达体系时仍然要重新筛选单克隆过程。同源重组或CRISPR/Cas9介导的同源重组技术,对已知强转录活性区实现同源重组,形成可定点插入目的基因的“Landing Pad”,大多数在强转录活性区。定点插入目的基因的细胞无需进行单克隆筛选,在有无选择压力条件下均可实现目的基因的高效稳定表达。但此技术还未大规模推广,主要原因应该技术还未成熟。
3.2 连续工艺
1)灌注培养工艺。流加工艺(Fed-batch)和灌流工艺(Perfusion)在达到相同的生产量,培养的体积可能相差10倍左右,所以在很多制药企业,在受场地限制和生产规模限制,而且随着Perfusion工艺技术的提高,很多产品会更加选择Perfusion工艺进行生产。例如,原来产品规模需要2000L规模,如果选择Perfusion工艺,可能仅仅需要200L规模。然而,国内使用Perfusion工艺生产单抗药物的企业局指可数,药明生物、嘉和生物、复宏汉霖等企业具有Perfusion工艺平台,其他大部分企业依然使用Fed-batch工艺。但Perfusion是单抗产业化发展的一个趋势,同时国内企业具有自主开发的培养基,成本也大大降低;国产品牌培养基发展迅速,例如奥普迈、中山康晟生物、建顺、倍谙基、多宁、源培、艾米能斯等,也降低了细胞培养成本。
2)灌注与流加结合培养工艺。由于灌注培养工艺中对培养基依赖非常大,对于成本的考虑,或者基于本身工艺的放大风险的控制。有企业开发的工艺会将灌注与流加结合的培养模式进行开发,例如在种子扩增阶段(种子罐)采用灌注培养提高种子密度,而最终大反应器即生产罐采用Fed-batch培养(14天)工艺,目的是可以节省更大的种子罐,同时降低大罐成本以及操作风险。
3)封闭系统技术。从上游到下游,尤其是DS和DP,工艺中提倡采取全程封闭系统,降低污染风险。此技术应用于CAR-T细胞治疗领域比较多,由于细胞治疗药物更需要封闭系统操作降低外源因子污染的风险。
4)层析连续流工艺。纯化工艺效率直接影响单抗产业化成本,国内浙江大学林东强教授提出了层析连续流、混合模式层析等理论,在纯化层析效率以及成本降低得到显著效果,尤其是层析连续流正在大规模生产应用。
5)在线实时监测技术。目前大部分工艺依然为离线监测,但在线实时监测是早期工艺开发、中试和GMP生产更贴近制药工业的GLP/GMP规范和PAT/QbD的设计理念。例如反应器中细胞密度、活率和细胞代谢产物乳酸、铵根离子、葡萄糖浓度、抗体滴度等等,还有下游纯化过程中杂质、物质结构等监控,目前工业上较多使用是Kaiser Raman拉曼光谱仪,无需取样,可以实时在线监测多个生物工艺参数。
3.3 大规模生产技术
对于单抗药物,一次性技术应用于单抗药物产业化越来越多,主要原因为:a)传统不锈钢设备,建厂时间长,CIP(在位清洗)和SIP(在位灭菌)成功昂贵以及验证复杂,交叉污染的风险高,运行成本高等;b)一次性生产技术无需:清洁洁净、消毒灭菌、建厂工程设计、产能验证等,降低建厂投资成本、降低厂房生产面积、提高批生产效率。目前国内大部分单抗制药公司生产厂房采用一次性生产技术。
基于封闭系统、连续工艺等新兴技术的发展,在大规模生产技术革新中,最近几年,提出模块化工厂理念,更加快速、高效的建厂与生产。
4. 国内生物制药挑战与机遇
4.1 国内生物制药企业创新理念
从国内单抗药物申报情况来看,绝大部分企业都是从事生物类似药(bio-similar或者bio-better),较少企业从事单抗创新药物。可能的原因:1)创新药物研发周期长、投资大、风险高,往往多数创新药物开发在临床阶段出现问题,最终不能成功。而生物类似药风险相对低很多,它的药效、毒理以及临床数据,已经具有参考,所以出问题的几率相对小;2)国内企业很少从事前期发现(discovery)工作,尤其是药物的发现和药物前期研究,毕竟企业是需要盈利,大部分企业不愿意从事这样的工作;3)国内生物制药企业,数量多,但不强。据不完全统计,国内有7000家药品生产企业,但能进入国际品牌的制药公司,寥寥无几。而国外的制药企业,尤其美国,制药企业投入研发的资金比例远远超过国内企业,并且大部分企业具有创新理念,例如辉瑞、罗氏、基因泰克等。
4.2 国内单抗行业趋势与机遇
由于单抗药物具有良好靶向性、临床副作用小等优点,而且国内企业进入单抗领域相比国外起步晚很多,在很多工艺技术、质量控制等方面比国外落后差距较大,所以在国家政策对生物制药(尤其是单抗药物)方面支持很大,如表,支持生物药自主创新研发,研发投入加大,多个单抗相关的课题获得国家重点自助;另外,从人口结构来看,随着人口老龄化的加剧,肿瘤和类风湿患者人数将越来越多,将会进一步拓展以两类疾病为适用症的单抗药物市场规模。
国内主要生物制药支持政策
时间 |
支持政策 |
2011.7 |
《国家“十二五”科学和技术发展规划》 |
2011.10 |
《医学科技发展“十二五”规划》 |
2011.11 |
《“十二五”生物技术发展规划》 |
2012.1 |
《医药工业“十二五”发展规划》 |
2012.7 |
《“十二五”国家战略性新兴产业发展规划》 |
2012.12 |
《国务院关于印发生物产业发展规划的通知》 |
2013.1 |
《生物产业发展十二五规划》 |
2014.3 |
2015年重大新药创制科技重大专项启动 |
2016.3 |
《关于促进医药产业健康发展的指导意见》 |
2017.1 |
《中华人民共和国国民经济和社会发展第十三个五年规划纲要》和《“十三五”国家战略性新兴产业发展规划》 |
2017.1 |
“十三五”生物产业发展规划 |
2017.6 |
中国加入ICH |
2017.10 |
《关于深化审评制度改革鼓励药品医疗器械创新的意见》 |
同时随着单克隆抗体的技术不断发展和成熟,抗体偶联药物(antibody-drug conjugate,ADC)和双特异性抗体在国内近几年发展较快,是未来重要的发展趋势。
推荐阅读:ADC药物深度分析:现状,发展和未来
单克隆抗体药物在国内市场空间巨大、国家支持政策较大、大量回国技术人员创业就业以及工艺技术日益成熟,在国内单抗行业是非常具有很好的前景。
5. 结语
目前中国抗体药物市场空间非常巨大,同时国家支持政策很大,人才不断聚集,单抗产业正进入关键的发展时期,鼓励企业和高校做创新药,同时开发自己的培养基和细胞培养工艺平台模式,积累大规模培养技术和生产技术,选择合适的CMC产业化方式,促使整个抗体药物产业健康发展。
6. 参考文献
[1]李心,龚珉,徐为人,等.抗体药物的国内外市场动态.现代药物与临床
[2]李 敏,吴日伟 等: 国内外单抗药物市场概述.中国生物工程杂志
[3]李浩强,蔡洁行,张玉彬.治疗性抗体高表达CHO细胞株构建策略.中国医药生物技术
[4]张弢,陈卫,浦迪,等.抗体药物研究进展与趋势.中国新药杂志
[5] Anna Kretschmer Ralf Schwanbeck Thomas Valerius Thies R ner, Antibody Isotypes for Tumor Immunotherapy,Transfus Med Hemother
[6] Lonza launches next generation GS gene expression system. Available online: http://www.lonza.com/about-lonza/media-center/news/2012/120710-GS-System-e.aspx
[7] Feng Li,Natarajan Vijayasankaran, Amy (Yijuan) Shen,Robert Kiss and Ashraf Amanullah, Cell culture processes for monoclonal antibody production.2010 Landes Bioscience:2010 Sep-Oct;2(5): 466–477.doi:10.4161/mabs.2.5.12720
[8] 陶维红,秦民民,张哲如. CHO细胞株开发技术策略探讨,生物技术进展
[9] 陶维红,李宗海,李荣秀. 我国单克隆抗体药物产业化进展浅谈,生物产业技术
[10] Goldman Sochs,China Biotech Primer
内容来源:小药说药 生物药知识云享
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多