解锁mRNA治疗药物前景
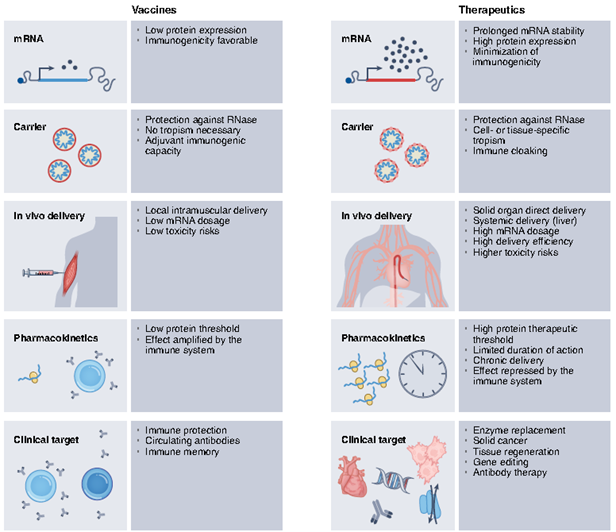
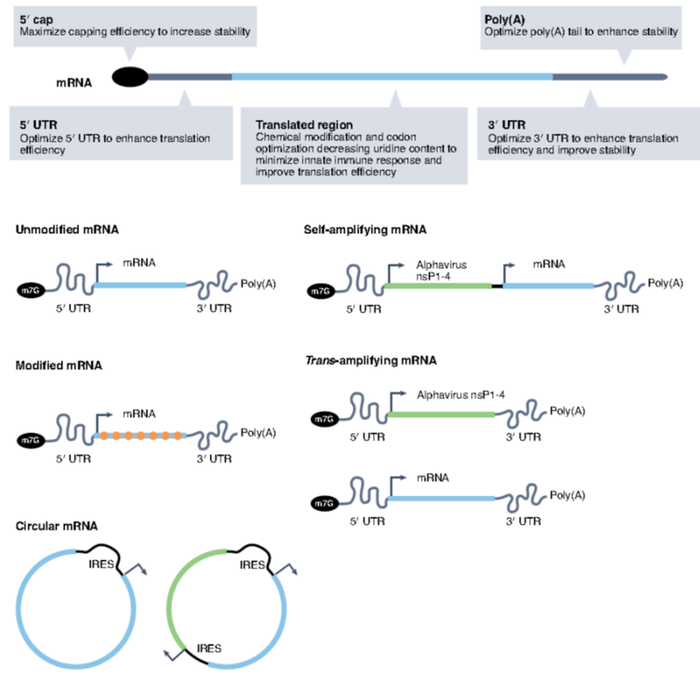
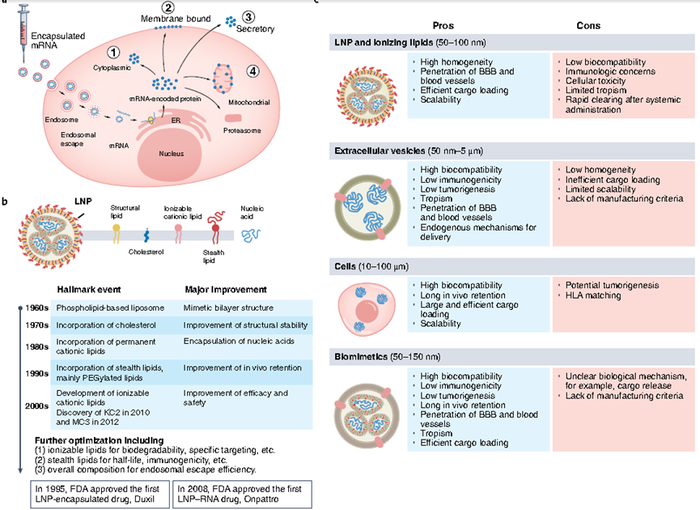
mRNA固有的免疫原性,虽然加强了作为疫苗的有效性,但是阻碍了作为需要更高水平蛋白表达的治疗药物。对高水平蛋白质表达的需求导致了优化mRNA载量的多种策略,以最小化先天免疫反应,增强mRNA稳定性并最大化翻译(见图2)。然而,对于任何给定的适应症,mRNA cargo的性质必须与递送系统的效率(例如,直接注射与全身注射)以及感兴趣蛋白的作用方式相关。
补充表1:mRNA治疗药物临床前
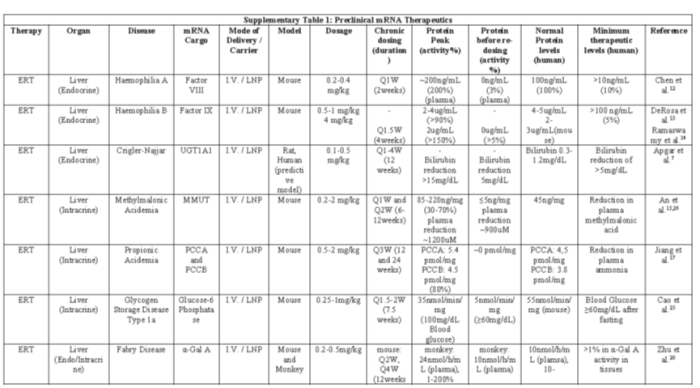
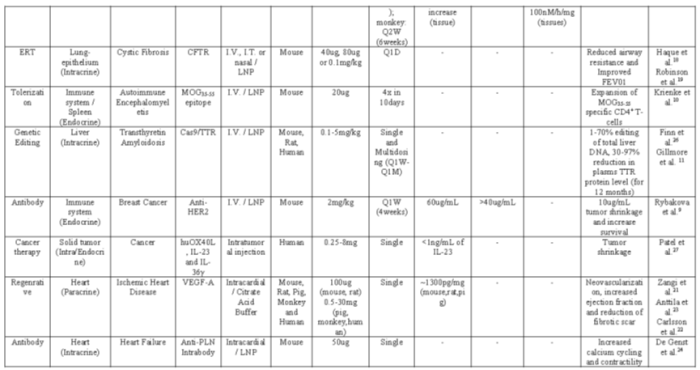
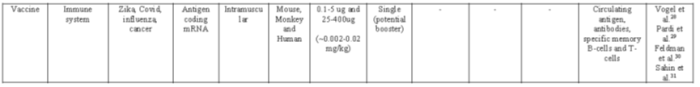
表1:mRNA治疗药物临床进展
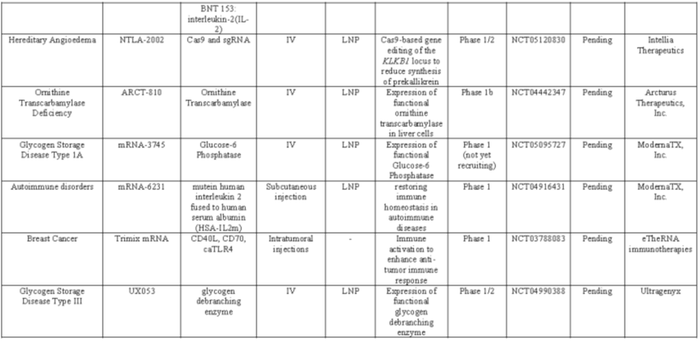
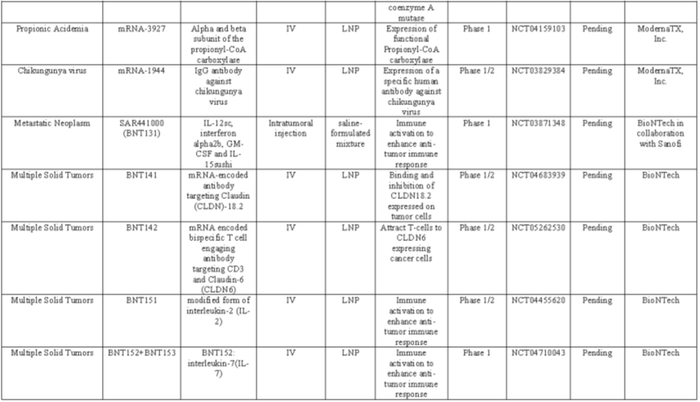
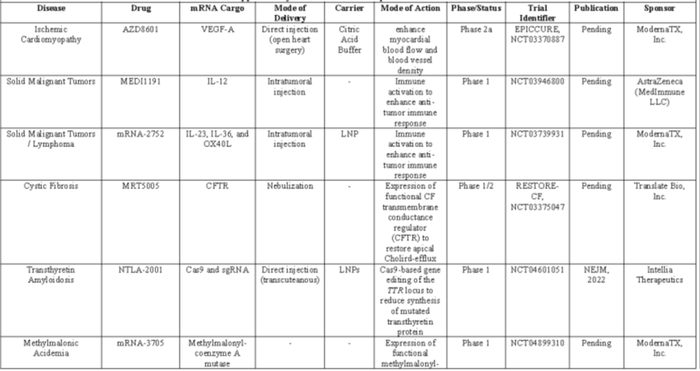
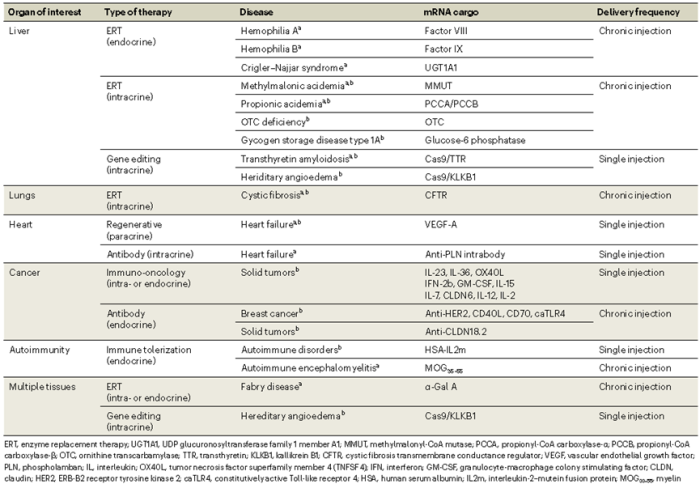
mRNA药物的未来可能取决于将这种“生命软件”与人类生理系统的生物“硬件”进行匹配,以提高精确度、延长持续时间,并选择具有可耐受安全性的长期给药。在未来几年中,细胞内载体和体内递送系统,加上生物学和临床洞察力和直觉,应该为许多未满足临床需求的患者提供新的希望。
参考文献:
Eduarde Rohner , Ran Yang, Kylie S. Foo,et al, Unlocking the promise of mRNA, Therapeutics, nature biotechnology, volume 40, 2022.10, 1586-1600
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多