一文讲清楚医药行业计算机化系统的基本要求
医疗器械/健康软件的适用性。
适用性
电子表格适用性
电子记录和电子签名法规的适用性
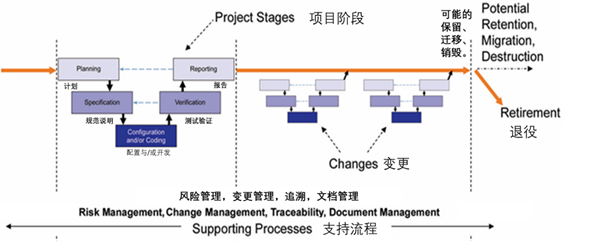
验证范围和数据完整性控制基于系统风险和软件类别。基于业务风险和/或影响的安全控制的范围(包括业务连续性和灾难恢复规划)。
维护系统、其预期用途和状态的清单应至少每年进行定期审查。
根据要求对进行重大升级的系统进行验证。
遵循生命周期方法,以确保系统验证、实施、操作和使用(包括系统的维护和退役)一致性。
3:验证:
计算机化系统针对其预期用途进行验证,并且对支持的基础架构进行确认。
验证定义系统将满足的需求(用户要求),以及系统如何通过开发、评估和确认来满足这些要求。
需求在整个生命周期中是可追溯的。
验证包括基于风险的测试和对验证过程中观察到的任何缺陷的报告,包括变更管理活动。
验证包含计算机化系统的最新系统描述。
与提供安装、配置、集成、验证、维护、修改或保留计算机化系统或相关数据处理服务的的第三方(供应商和服务提供商)建立正式协议。供应商\服务协议应包括明确的第三方责任说明。
如果令牌或卡片用于生成识别码或密码信息,则对设备进行初始和定期测试,以确保它们正常运行并且没有以未经授权的方式进行更改。
对于需要向监管机构提交记录或按照预定保留规则需要保存记录的计算机化系统(所有在范围内系统)设计为能够确保数据完整性不受损害。
记录和维护相关数据进行创建、修改和删除操作包含日期、时间和唯一用户标识符的记录(审计跟踪)。
记录更改不得掩盖以前记录的信息。
记录相关原始数据的更改或删除原因。
采取控制措施,以确保记录(包括审计跟踪)能够以电子或纸质形式检索,并在保留期内可用。
具备安全控制,以便根据GxP数据完整性要求,对于计算机化系统的认证、完整性和所对应的保密性进行管理。
个人用户访问控制(包括物理和电子)应进行配置和执行,以禁止未经授权的访问、更改和删除数据:
应根据职责分离原则为所有需要访问和使用特定电子系统的工作人员设置和分配个人登录和密码。
禁止共享密码。
数据输入和对计算机化记录的更改只能由(或委派人员)批准的授权人员进行。
应保留一份被授权用户名单及其正在使用的每个电子系统的访问权限,包括创建、更改和取消访问授权的列表。
系统管理员应独立于执行任务的用户
在通过不受控制的环境传输数据期间确保记录的真实性和完整性。
使用电子签名或手写签名的计算机化系统被设计为能够确保确保签名与电子记录永久关联。
电子签名包括执行签名时的名称、日期和时间以及签名含义。
防止未经授权修改或更改记录(包括原始数据)、审计跟踪和计算机时间戳(日期/时间)。
确保在迁移过程中数据的值和/或含义不会改变。
在系统之间以电子方式交换数据时,确保正确安全地输入和处理数据。
定义对存档数据的可访问性、可读性、完整性和可检索性的检查
包括设备(例如终端)检查,以确定相应的数据输入或操作指令来源的有效性。
维护每个识别码和密码组合的唯一性。
具有密码过期设置
遵照损失管理程序
使用交互保障措施
设备(例如令牌、卡)的初始和定期测试。
验证备份数据的完整性和准确性以及恢复数据的能力。
定期监控备份过程

开发,维护或使用电子记录/电子签名系统的人员,应当根据定义具有执行其分配任务的教育,培训和相关经验。
个人应当对其进行电子签名所发起的操作行为负责,以阻止记录和签名伪造。
定义流程以确保计算机化系统在验证状态下运行和维护。
对于支持关键流程的计算机化系统,应提供预案,以确保在系统发生故障时的业务连续性。采取替代行动的时间应基于风险,并根据系统和或系统支持的业务流程量身定制。
对计算机化系统进行定期评估,以确认计算机化系统保持经过验证的状态。定期审查的频率应以风险为基础。
在使用系统期间遇到的事件必须报告、评估和处置。
调查严重事件,并且实施基于根本原因的行动.
对计算机化系统的变更(例如,新部署、改进、错误修复、记录销毁、迁移、存档、组件报废/替换)利用变更管理以受控方式执行。
系统以受控的方式退役,利用变更管理进行迁移、存档、记录销毁和在达到生命周期终止时停用。
必须定义控制措施,以确保系统中的记录(包括审计跟踪)在整个保留期内可用,并作为系统退役计划的一部分。
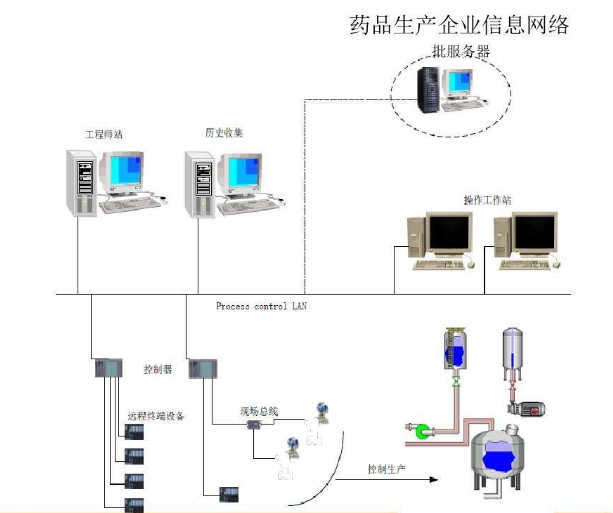
系统须保持在经过验证状态.
根据本文档中的要求对进行重大升级的系统进行验证。
本文来源于制药人职场加油站
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多