儿童罕见病临床试验大解析:让罕见病用药不再罕见
儿童罕见病试验数量逐年增加
但适应症和年龄分布不均
中国的罕见病儿童患者长期缺乏有效药物治疗,罕见病临床试验开展困难是其中一个重要原因。2022年为促进罕见疾病药物研发,《罕见疾病药物临床研发技术指导原则》在国家药监局药审中心(CDE)正式发布。
自2016年儿童药相关鼓励研发政策发布后,儿童临床试验数量保持连续增长。因此,针对罕见病领域开展儿童临床试验数量也随之不断增多。根据中国儿童用药数据库数据显示,截止至2022年第一季度,在中国公布第一批罕见病目录的121个罕见病中,已有19个罕见病开展了儿童临床试验,但中国儿童罕见病临床研究占儿童临床研究总数10.0%。儿童发育药理学的特殊性致使医学伦理审查更为严格,儿童临床试验受试者招募困难,是儿童罕见病临床试验甚至儿童临床试验少之又少的主要原因。
图1: 2014至2022Q1年中国儿童罕见病临床试验
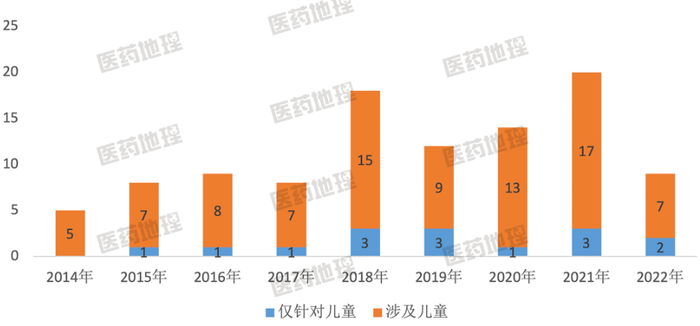
研究数量(按登记号计)
图2: 中国儿童罕见病临床试验研究数量
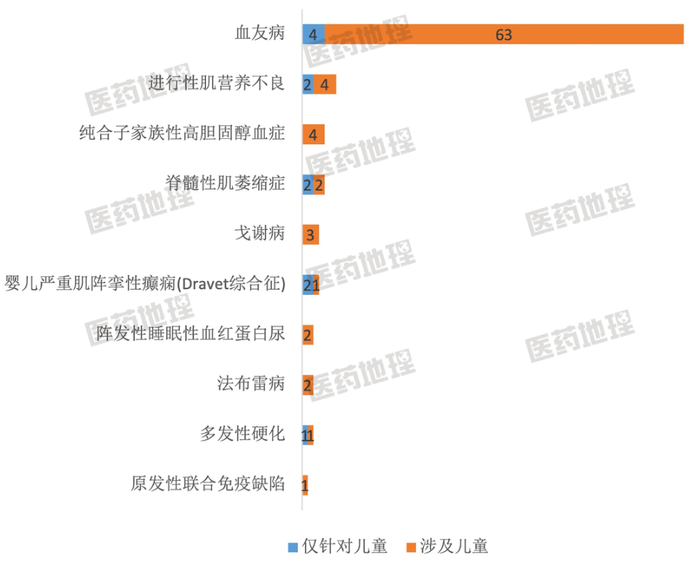
TOP10罕见病(按登记号计)
图3: 中国儿童罕见病临床试验研究人数

TOP10罕见病(按试验入组人数计)
无论从试验研究数量还是试验研究人数数量,针对血友病的儿童临床试验研究最多,远远多于其他罕见病,分布极为不均匀。值得注意的是自身免疫性脑炎是仅针对儿童开展临床试验人数最多的罕见病。
图4: 中国儿童各年龄参与罕见病临床试验
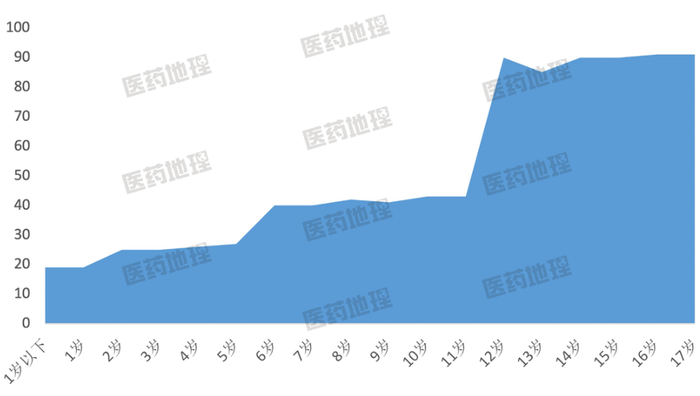
研究数量(按登记号计)
从开展试验的年龄划分来看,儿童罕见病临床试验主要还是集中在青少年期,针对学龄前的婴幼儿人群开展的试验受限于医学伦理,数量较少。
图5: 中国儿童罕见病临床试验研究数量
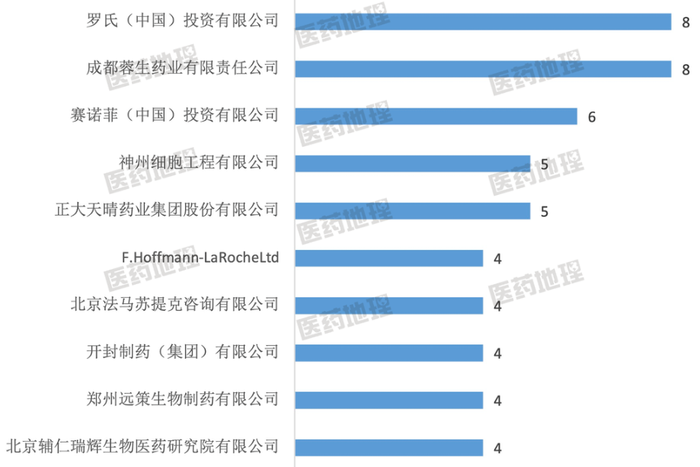
TOP10申办者(按登记号计)
从申办者来看,国内外机构各占半壁江山,罗氏(中国)投资有限公司、成都蓉生药业有限责任公司和赛诺菲(中国)投资有限公司是申办儿童罕见病临床试验最多的三个企业。
表1: 中国儿童罕见病临床试验药物及研发情况
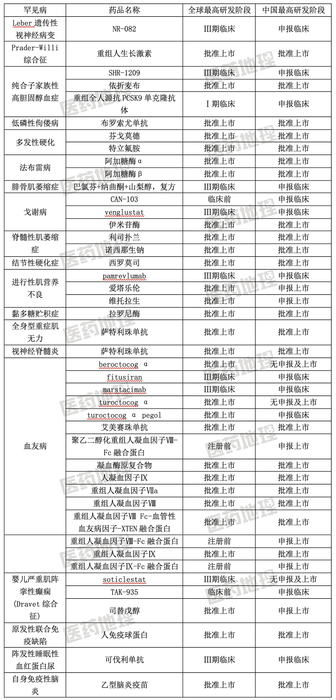
儿童罕见病药物研发任重而道远
我国儿童罕见病药物和临床试验的匮乏还是非常显著的,罕见病用药的研发是一个漫长的过程,通过全球和中国研发阶段的对比我们可以看到,像治疗进行性肌营养不良的爱塔乐伦、维托拉生,治疗婴儿严重肌阵挛性癫痫(Dravet综合征)的司替戊醇和治疗血友病的beroctocogα、turoctocog、αturoctocogαpegol都是国外已经批准上市的药品,让患者尽快用上国外已经上市的罕见病用药,解决一部分患者的药物可及性问题,也是解决罕见病用药匮乏的途径之一。
受限于罕见疾病底发病率,多疾病类型的特征,以及儿童人群参与临床试验的伦理局限,儿童罕见病药物研发任重而道远,希望此次发布的《罕见疾病药物临床研发技术指导原则》能进一步提高我们儿童罕见病药物的可及性,让儿童罕见病用药不再罕见。
本文来源于医药地理
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多