融合蛋白的糖基化表征
由于靶组织暴露有限,许多治疗性肽和蛋白质需要更频繁的给药间隔来维持临床有效的药物浓度;而Fc融合蛋白的出现,恰好解决了这一难题,其结合了生物配体的有益药理学特性和IgG的Fc结构域的特性,使IgG-Fc结构域与受体的配体、活性肽、或细胞外结构域的融合极大地提高了活性蛋白药物的临床潜力。
近年来抗体药物市场规模增长迅速,结构表征和质量控制的需求日益突出,糖基化作为抗体药物翻译后修饰之一,其对抗体药物的临床疗效、免疫原性、稳定性起主要作用。与单克隆抗体不同的是,Fc融合蛋白除在CH2结构域中包含一个典型的N连接糖基化位点外,通常在生物域中具有多个N-糖基化位点和额外的O-连接糖基化位点(图1)。这些寡糖结构具有更复杂的双天线、三天线和四天线结构。所有N连接的位点和多个O连接的位点都具有典型的哺乳动物低聚糖结构。这些糖结构被带负电荷的唾液酸残基 (唾液酸化),不同数量的唾液酸,连接到蛋白质上的不同位置,可以导致非常复杂的混合物。这种更复杂的糖基化可以通过唾液酸含量和末端N-乙酰氨基葡萄糖(GlcNAc)残基影响Fc融合蛋白在体内清除率,即影响其在体内的存留时间。
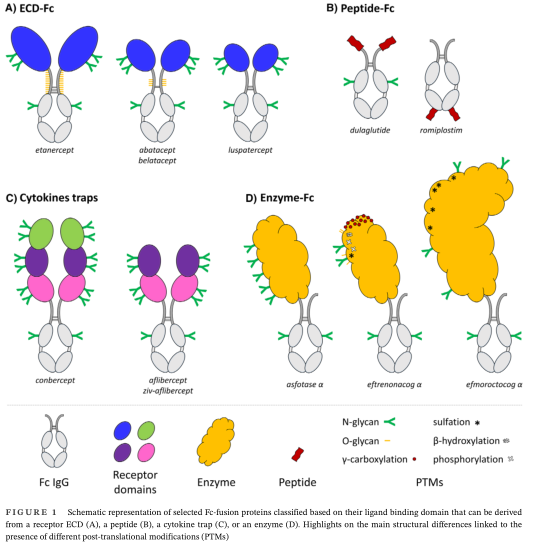
图1
糖基化对治疗性蛋白的免疫原性和临床疗效具有重要影响,被认为是 IgG 和基于IgG的治疗剂的关键质量属性。因此,监管机构要求糖蛋白制造商确定碳水化合物含量(中性糖、氨基糖和唾液酸)、寡糖模式和多肽链上的糖基化位点。分析过程中,使用三种主要方法进行糖蛋白分析:完整和亚基蛋白质水平、糖肽和释放的聚糖。
完整蛋白及亚基水平的分析
通常单克隆抗体重链Fc段有一个N糖修饰位点,经UPLC脱盐后直接进质谱进行分析。其优势在于,在ESI条件下,得到质谱数据经解卷积后可快速获得蛋白分子量信息及主要糖型的数据结果(图2)。对于生物类似药的开发,能够快速对比生物类似药的序列是否与原研药一致。
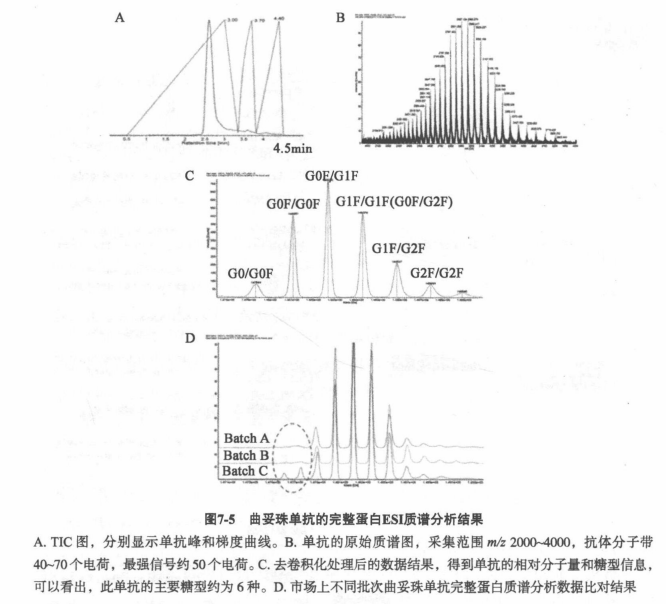
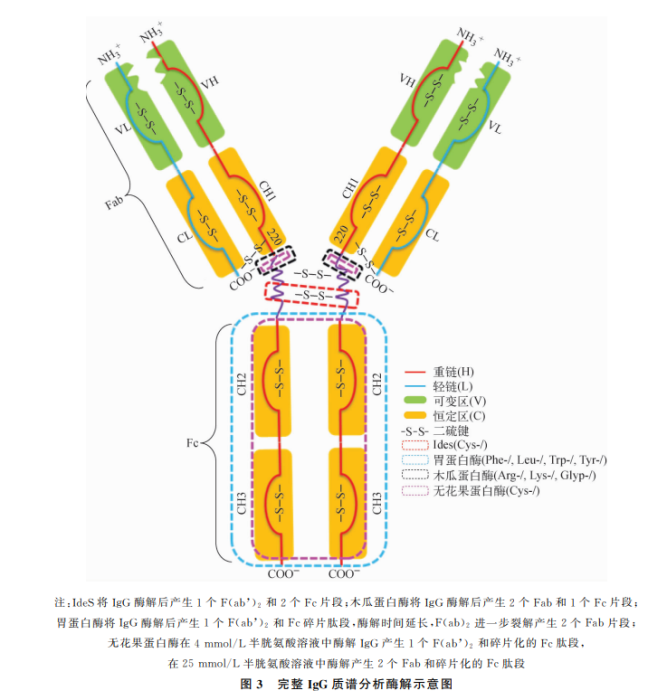
因为某些完整蛋白分子量大,结构复杂,给质谱检测后的数据分析带来挑战,因此多数研究会采用木瓜蛋白酶、胃蛋白酶等将完整蛋白酶解为Fab和Fc相关片段(可以根据蛋白结构不同,选择合适的酶进行酶解,图3),或者蛋白进行还原,分解成轻链和重链,降低质谱分析难度。
完整糖肽水平表征聚糖修饰
糖基化位点信息主要通过肽图技术获得,不同的蛋白酶消化糖蛋白,包括木瓜蛋白酶、胃蛋白酶、Lys-C(赖氨酰肽链内切酶)、Glu-C(谷氨酸蛋白酶)、IdeS、胰蛋白酶等以产生大约0.5-5kDa的肽和糖肽。然后使用MALDI-MS 或 ESI-MS 分析获得的肽,通过产生的肽碎片离子和由连接的聚糖产生的质量位移确定肽序列和N-糖链连接的位点。为了克服常规肽和高丰度糖肽的离子抑制效应,MS 检测之前通常先进行色谱(例如 RPLC 和 HILIC)或电泳分离技术(例如 CE),以确保对低丰度糖型进行可靠的表征。
糖链的分析
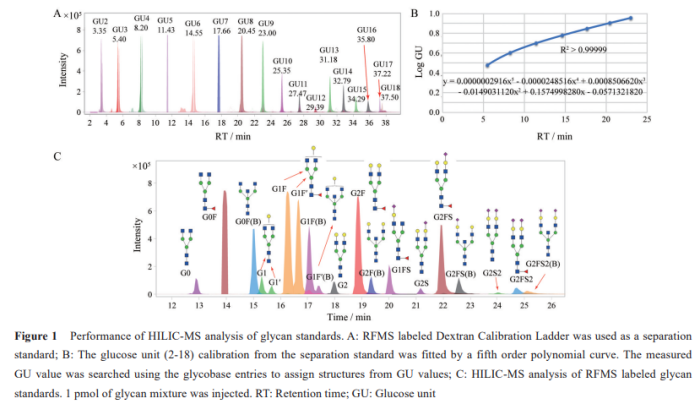
荧光标记释放的N聚糖的HILIC分析是用于质量控制和方法开发目的的聚糖分析中最常用的技术。抗体药物经N-糖苷酶F(PNGase F)处理后,经2-氨基苯甲酰胺(2-AB)或RapiFluor-MS试剂荧光标记(使用RapiFluor-MS 标记可显着缩短样品制备时间(~1 小时)并提高荧光和 MS 检测的灵敏度),随后使用HILIC柱分离标记的聚糖,将采集的糖型保留时间(RT)转换位葡萄糖单元(GU),与数据库中的糖标品GU值进行比较,结合一、二级质谱数据,进一步确认N聚糖信息(图4)。
唾液酸
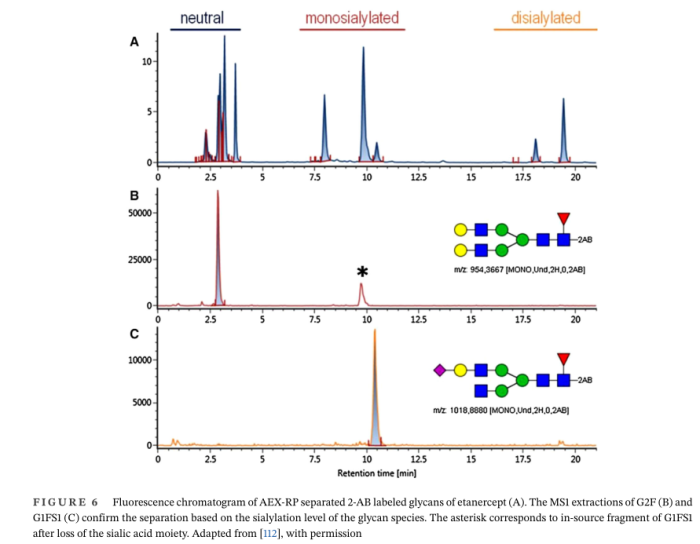
伴随着更复杂的N-糖链结构,更高的唾液酸含量对Fc融合蛋白的免疫原性和药代动力学(PK)参数起着重要作用。唾液酸谱可以与释放和标记的多糖一起进行,利用N-乙酰神经氨酸(Neu5Ac又名NaNA)和非人N-乙醇基神经氨酸(Neu5Gc又名NGNA)引入的负电荷,使用AEX层析分离,可以将中性多糖(非唾液酸化)从单唾液酸化、二唾液酸化和三唾液酸化的多糖中分离出来。
2017年,报道了一种AEX-RPLC方法,使用两种正交分离技术,多糖的疏水性(RP模式)和电荷(AEX模式)来分离依那西普的聚糖种类,因此,唾液酸化基团(即无、一元、二元、三元等)彼此完全分离(图5)。
若要区分唾液酸的类型,例如NGNA和NANA,需从多糖化学中释放唾液酸并用DMB进行荧光标记,对于许多Fc融合蛋白,唾液酸不仅存在于N-糖链上,也存在于O-糖链,与N-葡聚糖相比,O-葡聚糖具有高度多样化的核心结构。然而,O-葡聚糖可以随机连接到氨基酸的羟基上,例如丝氨酸和苏氨酸,从而在Fc-融合蛋白上产生大量的推测的O-糖基化位点。因此,获得糖链结合部位的特定信息对于准确分析糖链图谱是很重要的。当相同的糖链分布位于Fc融合产品的IgG结构域或融合伙伴结构域中时,存在PK差异。因此,糖基化模式的位点特异性信息对于进一步开发治疗产品的临床潜力和更好地了解CQA是至关重要的。
案例分享
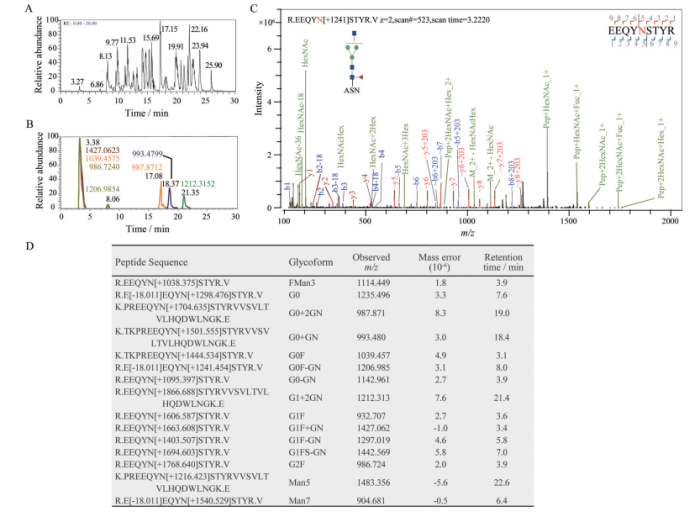
例如在贝伐珠单抗中, N-聚糖修饰主要位于肽段EEQYN*STYR上。糖肽 EEQYN*STYR在 3 min左右洗脱 (图6B)。该肽段上的主要糖型包括 G0、G0F、G0F-GN (图6D), 其他相对丰度较低的糖型包括FMan3、G1FS-GN、Man5、Man7等。糖基化修饰位点可通过二级质谱图进一步判断 (图6C) 知, 该糖肽上存在的糖型为 G0F-GN, 位点在 303 位的天冬酰胺残基 (Asn303) 上。在其他保留时间如 17~21 min亦有糖肽洗脱, 但其信号强度较低。这些在反向谱中保留较强的糖肽氨基酸序列较长, 如在19 min洗脱的肽段由27个氨基酸组成 (K.PREEQYN*STYRVVSVLTVLHQDWLNGK.E), 可能来源于胰蛋白酶对特定氨基酸 (K或R) 的漏切。
依那西普是一种~13 0 kDa的可溶性Fc-融合蛋白,由人p75 TNFR的胞外段结合到人Fc- IgG1结构域组成。Fc结构域具有一个典型的N-连接糖基化位点,在TNFR-结构域具有两个N-连接糖基化位点。此外,在Linker区发现13个O-连接糖基化位点,N-和O-连接的多糖(∼30 kDa)形成了一个高度不均匀的糖基化图谱,这被认为是依那西普的一个重要的CQA。
首先用PNGase F和唾液酸酶来去除所有N-连接的糖链和O-连接的糖链上的唾液酸残基,然后将糖蛋白与胰酶反应,生成胰蛋白酶多肽,进行LC-MSE检测。
据释放的O-糖链的分析表明,依那西普只存在末端含唾液酸残基的核心1型O-糖链。依那西普上唾液酸化O-葡聚糖结构的存在也表明,可以使用α(2→3,6,8,9)唾液酸酶在酶作用下削减唾液酸残基,从而在肽骨架上留下一个中性的六角NAc(核心1)标签,最后通过在LC/MSE分析过程中鉴定出所有含核心-1的糖肽(表1)。

表1
小编总结
糖基化修饰对抗体药物的物理化学特性有着重要的影响,在不同慢性疾病,如甲状腺癌、肺癌、胃癌等中均发现了异常变化,糖基化修饰对治疗性抗体的安全性和临床疗效有着深远的影响。Fc融合蛋白的糖基化谱非常复杂,包括存在多个 N-和 O-聚糖位点以及大量唾液酸,因此,需要高度创新和互补的分析方法进行糖基化表征。
参考文献
1.Largy E, Cantais F, Van Vyncht G, Beck A, Delobel A. Orthogo-nal liquid chromatography–mass spectrometry methods for thecomprehensive characterization of therapeutic glycoproteins,from released glycans to intact protein level. J ChromatogrA. 2017; 1498: 128–46.
2.Houel S, Hilliard M, Yu YQ, McLoughlin N, Martin SM, RuddPM, Williams JP, Chen W. N- and O-glycosylation analysis ofetanercept using liquid chromatography and quadrupole time-of-flight mass spectrometry equipped with electron-transferdissociation functionality. Anal Chem. 2014; 86: 576–84.
3.Bastiaan L. Duivelshof,et,al., Therapeutic Fc-fusion proteins: Current analytical strategies. J Sep Sci. 2021 Jan; 44(1): 35-62.
4.赖治臻,周巾煜,李智立.免疫球蛋白G糖基化修饰的质谱分析方法及其应用[J].质谱学报,2021,42(5):879-896.
5.李梦林,朱文文,张金兰.基于N-聚糖和完整糖肽的单克隆抗体药物糖基化修饰表征[J].药学学报,2021,56(9): 2360-2366
来源:甲贝医药
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多