集成式连续生物生产框架的设计基础
这里描述的工厂和设备设计可以生产大量的重组蛋白,以满足任何市场的需要。很少有产品每年需要超过1吨的物料;而本框架设计产量为8吨/年。
世界迫切需要可快速扩张的生产空间,每年可能需要8吨。由于COVID-19病毒大流行,许多企业正在购买大型不锈钢设备,用于抗体治疗。扩大这些设施将需要大约5年的时间。此外,这些设施耗资4 -8亿美元。最后,出于供应链方面的考虑,许多国家和地区希望在其政治影响范围内生产这些COVID-19治疗药物。
通用框架设计使用一次性设备,其生产率与大型不锈钢工厂一样高。通过使一次性技术具有相当的成本效益,通用框架允许在几乎任何地方快速、相对廉价地构建大产能生物制造。
所提供的例子包括使用低生产力细胞系的500L生物反应器和使用高生产力细胞系的2000L生物反应器。500 L的生物反应器每天在生物反应器中产生约0.5 kg的物料,20天后形成6 kg的批次。2000 L的生物反应器每天生产约10kg的物料,20天后生产120 kg的批次。一个包括4个2000 L反应器的工艺被描述为可在20天内生产高达500 kg的批次,或每年以17个批次生产大约8吨物料。这些上游选项与下游设计集成在一起,足够灵活,可以实现高低限值差近10,000倍的产能范围。
这里,我们将讨论设计的细节,以展示框架ICB的灵活性和生产力,包括单元步骤的详细情况。
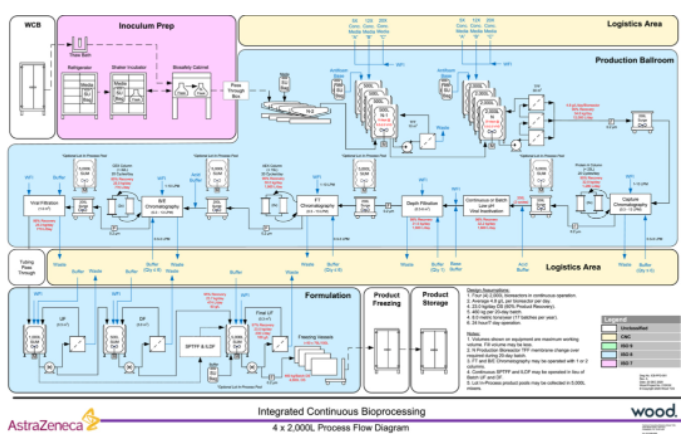
图1. 集成式连续生物工艺的通用框架,展示了从种子冻存管到药物底物的工艺流程。
生物反应器设计
通用框架生物反应器设计旨在支持高细胞密度。最大的设计挑战是为细胞提供氧气以及二氧化碳脱气。高细胞密度所需的大量营养物质需要开发培养基浓缩物,以及使用多种补液溶液的可能性。高密度的细胞还需要冷却以保持温度。尽管这些挑战会以多种方式影响生物反应器的设计,但它们并不排除生物反应器被用于标准补料分批操作。
细胞密度不使用废弃(bleeding)直接控制时,动态 - 或称非稳态 -灌流可以达到 100-150 x10^6 cells/mL 的细胞密度。如原文表 2 所示,该细胞密度范围需要 15 - 50 mM/hr的氧气传输速率。这需要15 - 70 hour-1 的气/液传输系数 kLa。细胞消耗氧气的速度如此之快,以至于如果不使用鼓泡通气,它们在不到10 sec的时间内就会缺氧。此外,还有一些在实验室或中试规模条件下达到240 x 10^6 cells/mL 灌流细胞培养的案例。如果要扩增到这种细胞密度,则需要超过100 hour-1 的 kLa,或更低的细胞特异性氧气摄取率。
灌流培养的通气策略是控制溶氧 (DO)、pCO2 累积(即pH 和随后的碱利用)以及泡沫形成之间三方面平衡的行为。在任何一个方面实现期望的控制可能会在另一方面导致不期望的结果。
向细胞供应氧气很容易成为实现高细胞密度的限制因素。质量-流量控制器和鼓泡的设计需要仔细考虑。一般来说,为灌流工艺输送空气和 O2 的质量-流量控制器需要比补料分批工艺更高的流量,范围从0.05vvm 到 0.2vvm。关于鼓泡设计,已证明微泡可提高在灌流规模细胞密度条件下实现所需 DO而要求的氧气传输能力。然而,微泡引起了一些担忧,包括当微观气泡破裂时,它们可能会因剪切而导致细胞损伤。研究还观察到微泡会产生比传统大泡(即环形或钻孔鼓泡)更高的pCO2 积累,这会降低培养液的 pH 值,并提高碱的使用,继而增加细胞应激和细胞凋亡的速率。此外,微泡产生比传统鼓泡更厚的泡沫层。这种厚泡沫需要强化的控制方法,需要注意其对生物反应器排气的污染。
由一个微泡和一个大泡组成的双鼓泡设计在配置气流、以平衡灌流生物反应器中溶氧、溶解二氧化碳以及泡沫管理的要求方面具有最大的灵活性。在该设计中,微泡部件通常通过相对较小的气泡向培养液提供所需的溶氧,而大泡部件通常通过从具有相对较大的气泡的系统中进行二氧化碳脱气而提供管理pCO2 积累的手段。双鼓泡设计还可以提供额外的好处,即通过两种尺寸的气泡之间的破坏作用来减少产生的泡沫量。
即使采用双鼓泡设计,灌流培养中的泡沫和气溶胶管理仍更困难,因为与补料分批培养相比,搅拌和气体流量相对更高。第一道防线是通过机械干扰、调整叠加湿度以及根据泡沫生成速率和泡沫厚度自动添加消泡剂等手段来管理生物反应器本身的泡沫形成。冗余过滤器和/或排气陷阱是排气歧管的重要组成部分,用于管理泡沫和气溶胶的收集,以及在保持无菌边界的同时,无缝切换单元操作。先进的过滤系统已证明了其管理泡沫和气溶胶产生的强化能力,可考虑在任何生物反应器排气歧管中使用。
灌流生物反应器通气策略的最后一个考虑因素是控制策略。对于保持DO、pCO2 积累和泡沫生成之间的平衡至关重要的是,为控制这种平衡的参数建立特定于生物反应器的关系,包括给定气体种类和鼓泡设计的气体传输(即kLa)。因此,灌流生物反应器控制架构必须允许使用相当复杂的算法,来管理这三个控制元素,以及整合所谓的离线、近线和在线检测,例如细胞密度、温度、乳酸浓度、葡萄糖浓度和pH 值。
与补料分批相比,高细胞密度灌流的培养基输送也会不同。培养基是浓缩的,可以通过多个液流而不是一个液流。在原文表 1所示的场景中,培养基浓缩液由 5x、12x 和20x 浓缩液组成。将需要尺寸从 0.02 VVD 到 0.3 VVD 的多个培养基补液泵。对于 2,000L 的生物反应器,这个范围将为 20 - 400mL/min。还需要以更小的流速添加葡萄糖浓缩液和消泡剂。泵速应该能够通过依赖于PAT 或机械模型的复杂计算来设置,类似于通气可能需要的那些。需要整体生物反应器液位控制来控制补液或滤液流速。
培养基浓缩液可以用静态混合器通过一条管路加入。通常,一条纯水管路进入静态混合器,一系列T型连接允许以串行方式混合每种浓缩液。
培养基浓缩液的使用大大减少了培养基制备和培养基存储区域的大小。在原文表1和表2所示的4 x2,000 L场景中,培养基可储存在16个5,000 L的一次性容器中。20x培养基需要一个额外的2,000 L容器。
这些生物反应器可能会放热并需要冷却,因为细胞的数量特别多,这是与批次哺乳动物细胞培养相比,灌流的一个新问题。当细胞密度在50- 150 x 10^6 cells /mL之间时,细胞产生约28pW/cell 或1.4 - 4.2 W/L热量。一个2,000 L的罐可以产生3,000 W到8,000 W的热量,这很容易通过修改加热夹套来实现冷却。然而,冷却一个12 kL的生物反应器可能成为一个挑战,因为细胞可以产生高达50 kW的热量。可能需要一个与灌流过滤系统相连的热交换器。
一个可能适用于临床生产工厂的设计如原文表1和表2中的列1所示。500 L生物反应器在50x 10^6 cells/mL的条件下运行,使用产量为20 pg/cell/day的细胞系。这一场景是一种可以通过将补料分批工艺转化为灌流细胞培养而实现的方案。它还代表了可能在开发早期出现的情况,即此时还没有进行工艺优化和强化。
商业化生物反应器的设置如原文表1、表2和列3所示,平均细胞密度为120 x 10^6 cells/mL,细胞系产量为40 pg/cell/day。在这种情况下,4个2,000 L的生物反应器被用于供液至单个下游工艺链。这些生物反应器平均每天生产38 kg。在20天的运行过程中,超过500 kg的物料被汇集到单个批次中。
双柱层析设计
双柱层析法是ICB中最简单、也可能是最容易的一种实施方式。图1所示的高水平层析系统设计允许实现针对ICB和批次工艺的灵活性。该系统使用两种泵尺寸。一个较小的泵用于溶液浓缩液。较大的泵用于稀释和上样。本设计具有较大的处理范围。整体准确流量范围为0.3-13 L/min。虽然该系统被许多人用于所有三个层析步骤,但是ProteinA捕获步骤决定了该工艺的生产力和时间。
高生产力的工艺使用溶液浓缩液并以水稀释。该系统最大的处理能力可能是两根柱床高度为10 cm的并行操作25 L柱,允许产量57.6 kg/day。可以处理的最小量为仅使用较小的泵,不进行稀释,在最低准确的流量下,允许使用0.6L柱。这种设置每天只处理36 g。由于柱的有效载量下降,两柱并行操作(标准批次操作)只能处理48 kg/day。因为这些柱子不会串联操作,其长度可以为20 cm,每根 50 L。也可以考虑使用单柱捕获步骤。在一根 43 L的柱上,只允许实现大约24 kg/day的产量,并且支持更小的生物反应器体积。在相同的Protein A体积下,这个量低于双柱系统的一半。由于后两种方法不会使Protein A层析柱过载,并依序运行第二根层析柱来捕获流穿层析柱的产物,因此从监管角度来看,其与双柱层析操作不同。它们可能需要不同的工艺表征和工艺性能确认包。
下游工艺可以通过两种方式调整大批量生产。首先,捕获柱可以减载。假设Protein A的负载范围为10 g/L - 72 g/L。第二,根据滴度的不同,这些层析柱可每天循环低至一次,到约每天循环大约15次。在一定程度上,生物负荷控制策略设定了最低限度,因为我们更倾向于在对柱进行消毒之前,在12小时内上样。因此,产量的总批次内范围超过200倍。在批次之间,层析柱的尺寸可以从0.6 L改变到25 L。因此,整个下游批次间的产量范围是惊人的9000倍范围。精纯步骤可以以类似的模式操作。
设置每天的平均循环数,以避免在商业化工艺的20天运行期间更换层析柱。每根Protein A柱平均每天循环10次,每批次总循环200个循环。精纯步骤每天循环12.5次,以获得最大的生产力,每批次总循环250个循环。虽然层析柱寿命可能因产品而有所不同,但Protein A步骤的目标为200个循环,精纯步骤的目标为250个循环,这对商业工艺来说不是太繁重。较差的层析柱寿命将需要更大的层析柱和每天更少的循环,或在批次期间更换层析柱。
框架还建议使用两种光程的UV吸收检测,以允许高浓度和低浓度的测量。理想情况下,UV检测器可保持线性达150 g/L或约200 AU/cm,以捕获洗脱峰的最大浓度。0.1 mm和1.0 mm光程检测器足够了。这些检测限是必要的,以实现每个循环准确的收率计算。此外,该检测器需允许从230 nm到320 nm的吸光度扫描。层析柱峰的光谱分析可以用来估计纯度。
双柱层析系统可能不会因一次性使用而受益,这取决于应用情况。较小的批次规模将增加一次性使用组件的COGM负担。但这种负担在临床生产中不那么重要,在临床生产中,灵活性和转换时间可能更重要。对于非常大的批次来说,也不那么重要,比如4 x2,000 L的批次例子。
双柱系统向后兼容批次工艺。如果4个生物反应器在不同的日子收获,对于每个反应器,下游可以处理48k g/day,或者24 g/L滴度的补料分批。该滴度是远远超过任何标准补料分批工艺。
深层过滤
在低 pH 病毒灭活之后,高密度补料分批工艺会沉淀 HCP 和其它杂质。通常通过深层过滤器去除微粒。
基于灌流的工艺不会以与补料分批工艺相同的频率或程度沉淀。即便如此,框架工艺也需要添加深层过滤器的灵活性。深层过滤器对于连续工艺具有挑战。没有多少深层过滤器提供无菌或低生物负荷规格。这意味着深层过滤是生物负荷进入工艺流的机会。一些深层过滤器可以用各种溶液消毒,氢氧化物是最典型的。
由于假设深层过滤器处理能力较低(200 L/m2),因此需要经常更换。该框架假设每天都在更换,主要是为了避免无法消毒的深层过滤器中的生物负荷。过滤面积与Protein A 柱体积成正比,从临床工艺的0.3 m2 到500 kg 工艺的6 m2不等。虽然 6 m2 在小型生产工厂中很常见,但最好用自己的泵系统冲洗。
除病毒过滤(VRF)
除病毒过滤为生物制造中的病毒清除提供了稳健且可放大的解决方案。合适除病毒过滤器的选择取决于进样特性和工艺参数的组合。据报道,低流速和伴随的压力可减少病毒截留。这种影响取决于诸如pH 值、离子强度和膜组成等因素。对许多人来说,连续操作下的这种截留损失会将VRF 工艺限制为批次操作。原文表 1 和 2 描述了第二个精纯步骤之后恒定流速VRF 工艺的各种情况。如表 2 所示,低生产力情景需要 0.5 m2 的膜面积。每个VRF 子批次预计每隔 24 小时运行一次。在这里,每个子批次大约需要三个小时,以 24 g/L 产生 277 L的最终产品池(表 2)。
超滤和洗滤(UF/DF)
通用框架工艺可实现批次和单程 (SP) 超滤/洗滤(UFDF)。该框架使用具有相同泵和不同流路的灵活一次性系统,以适应两种操作。
批次 UF/DF 步骤如原文图 1 所示,包括批次切向流过滤(TFF) 和再循环系统,以达到所需的产物浓度。框架工艺频繁执行批次UFDF,以避免使用大型系统。整个 UF/DF 工艺将被分成多达 20 个子批次,这些子批次预计将与VRF 工艺同步。随着运行的进行,浓缩步骤连续进行。定期将浓缩池移至进行洗滤的DF 截留罐。物料被移动到最终的过程中截留池中,随着运行的进行,最终的UF 浓度不断出现。原文表 1 和2 描述了典型TFF 组件的工艺参数和产量。通过控制批次操作的频率,使用的过滤器和泵的尺寸在所有规模上都相似。用于临床 6 kg DF 的过滤器为 0.2-1 m2,而用于商业化 500 kg批次的过滤器为0.4-4 m2,分别被分批一次和二十次。
高生产率批次所需的 DF 缓冲液体积可能高得令人望而却步。对于 500 kg 批次,DF 缓冲液体积为66,000 L,占下游溶液总体积的 25%。这个问题可以通过使用缓冲液浓缩液或在线调节来部分缓解,最后的这一步需要精确的泵。
最近,文献中报道了克服典型 UF/DF 操作不足的替代方法。单程切向流过滤 (SPTFF) 膜过滤组件的出现使得在单程中获得高蛋白质浓缩因子成为可能,同时消除了重复产物循环的需要。研究已经证明了以并流和逆流模式使用多级SPTFF 级联对蛋白质进行连续洗滤。原文表 2描述了 SPTFF 组件的实施建议,图 1 显示了用于集成和连续UF 和逆流-DF (CC-DF) 工艺的 SPTFF 组件的实施建议。这里,对超滤工艺的进料流量进行调整,以便在24 小时内分散每个 VRF 子批次池。这允许超滤工艺在整个批次中不间断地运行。然后将截留液流直接送入三级CC-DF 级联,无需缓冲罐。与批次 DF 操作相比,DF 缓冲液的逆流流动导致缓冲液使用量至少减少40%,这主要是因为 CC-DF 步骤在更高的产物浓度下操作。
一些泵在 UFDF 和 SP 选项之间不匹配。多头蠕动泵可以大大简化泵的设计。组件上使用的泵可以根据应用使用高流速和低流速管路。
最近的报告还成功地证明了使用中空纤维透析器进行缓冲液置换。框架系统还将实现此步骤的操作,这有可能将批次UFDF 选项所需的总 DF 缓冲液减少 8 倍。
总结
通用集成式连续生物工艺框架使设备设计足够灵活,可以处理 6kg到 500 kg的批次大小。该设计还为某些批次操作提供了灵活性,并与传统工艺兼容。
在大流行期间,这种灵活的、主要基于一次性使用的设计在今天具有特别的需求。虽然目前大多数COVID-19 mAb 项目都是以补料分批进行的,但从补料分批转换为ICB 是可能的。虽然转换为 ICB 在短期内可能不能达到立竿见影的效果,但它将允许生产在大约两年内扩张。从监管角度来看,转换为灌流生物反应器将是一个相对较大的变更,并且需要强大的可比性文件包。另一种选择是产能紧缩和在世界各国投资数十亿美元的不锈钢基础设施。大流行证明了生产中的不确定性:抗体生产可能在很多年内需要,也可能不需要。此外,可放大 mAb生产的快速发展将有助于下一次大流行。
ICB 框架允许公司围绕现成的设备协调他们的平台。此外,合同制造商可以购买与批次工艺向后兼容以及未来与ICB 兼容的设备。迄今为止,这种灵活性尚未完全实现。许多公司认为ICB 是向前迈出的一步,没有回头路。原文证实了通用框架ICB 可以着眼于未来而设计、购买和安装,而无需担心过去。
本文节选、翻译自以下文章,由于水平有限,详细内容,请参考原文。文章旨在知识分享,如有任何问题,请联系处理。
原文:J.Coffman, K.Bibbo, M.Brower, et al., The Design Basis for the Integrated and Continuous Biomanufacturing Framework. Biotechnology & Bioengineering, 2021, https://doi.org/10.1002/bit.27697.
本文来源于生物工艺与技术
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多