生物制药一体化连续生产工艺的科学及法规监管现状

重组DNA技术的应用迅速而显著地改变了全球制药行业的格局。1982年10月28日,美国食品药品管理局批准礼来公司的重组人胰岛素,开始了商业生物技术制药时代。时至今日世界上Top10的大多数都来自于重组生物工艺,其中单克隆抗体产品是市场上增长最快的药物产品类别之一。生物技术药物在美国受FDA《Food Drug and Cosmetic Act》和PHS《Public Health Service》监管。临床开展是根据临床试验新药申请(INDs)进行,而实际产品上市申请是作为生物制剂许可申请提交的,包括生物仿制药。生物制药技术的主要市场驱动力一直是最小化开发时间和最大化成本控制。这导致了对创新药物开发的关注,而不是工艺本身。生物仿制药的出现改变了市场的驱动力,更有效地提供高质量产品的生物工艺可以实现成本优势。为了解决生产和质量问题,整个生物制药行业的一个主要趋势是生物工艺过程强化和连续化生产工艺。
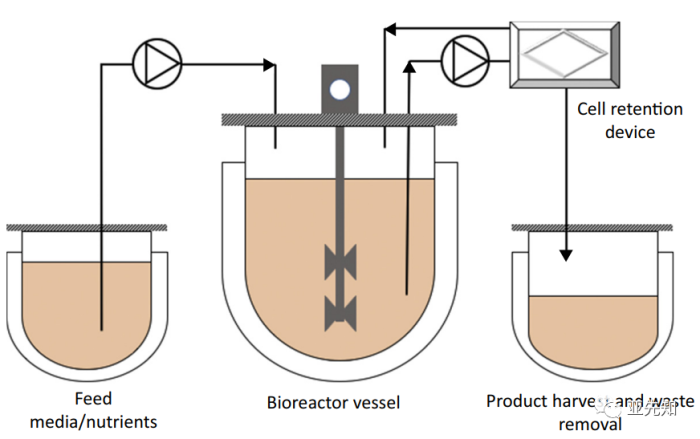
问题1:Batch 指的是什么?
一个常见的误解是,连续生物工艺与批次(batchs)和批(lots)的概念不兼容。事实上,法规将批次描述为在同一生产周期内按照单一的生产订单形式,在规定的限度内,生产特定数量的,具有统一特性和质量的药品生产过程。“lot”是“batch”的同义词,或者是“batch”中特定确定的部分。在这两种情况下,定义都是基于材料的数量,而不是制造方法。
在连续生产过程中,材料的可追溯性应与批次的定义紧密联系。批次可以基于一定数量的生产时间、一定数量的产品、设备能力限制或新材料的引入(即不同的原料批次)。在每一种情况下,批量定义都应与过程的控制策略联系在一起,以具有代表性的抽样策略为后盾,确保产品具有统一的特性和质量。由于连续过程适合当前的监管范式,其他监管方面的期望,例如过程验证和质量管理体系,对于连续生产过程和批处理过程没有不同。
FDA批准将PREZISTA (darunavir)的生产从批次模式变更为连续工艺,为生产的进步提供了一个明确的信号,在其《Advancement of Emerging Technologies Applications to Modernize the Pharmaceutical Manufacturing Base guidance》中阐明了这一点,这对于寻求启动集成式生物工艺的生物制药厂商而言非常重要。2 连续生物工艺的科学和监管挑战
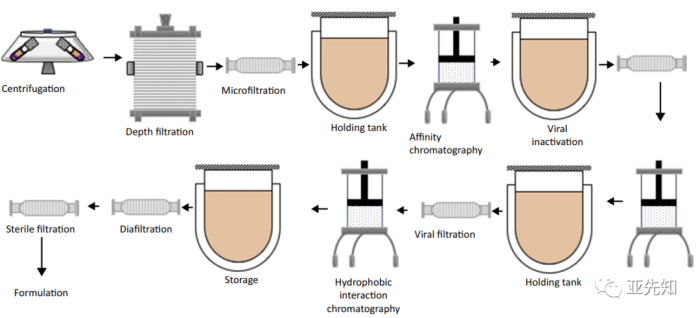
虽然生物制药上游连续工艺已经相当成熟,但下游连续工艺的一体化整合仍在发展中。传统单抗生产工艺,上游细胞培养之后是连续的批处理单元操作传统的下游生物制造工艺包括过滤、层析和最终配方的组合。大部分的细胞通常由最初的离心除去。根据产品的不同,在最后的除病毒/无菌过滤步骤之前可能需要两到三个层析过程,以获得目标产品。
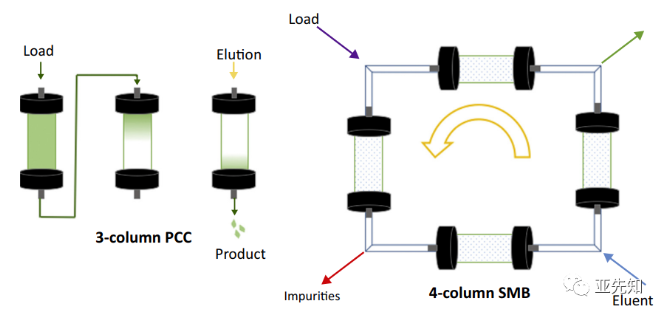
对于下游连续工艺:需要对目标产物进行连续捕获和精纯,两种主要的选择是周期性逆流色谱(PCC)和模拟移动床色谱(SMB)。层析单元操作通常包括上样、冲洗、洗脱和再生步骤。在PCC和SMB色谱,多个柱子串联以循环的方式运行这些步骤。在PCC中,从层析柱中流出的样品的流动被重新上样至到后续的层析柱中,以提高工艺收率。但各层析柱仍要经历上样-冲洗-洗脱-平衡的循环。在SMB中,每个色谱柱的入口是周期性移动的,允许连续上样、洗脱和收获,从而减少缓冲液和树脂的使用。
尽管在采用连续生物工艺经常受到监管方面的挑战,但FDA在1993年批准了第一个通过连续灌注生产的生物制药产品,今天大约有20个上市的生物产品,来自于多个公司,使用灌流或其他连续生物工艺。
FDA倡导在制药生产过程中遵循质量源于设计(QbD)。QbD概念需要理解药品性能,以识别产品的关键质量属性(CQA);了解了这些知识后可以对工艺过程或配方进行设计,以生产出具有CQA的产品:理解原材料和工艺参数的变化对CQA的影响,并充分控制这些变化的来源。在许多方面,过程分析技术(PAT)是实现QbD的工具,PAT框架允许设计和开发生产工艺,提供一致的、特定质量的产品。
在PAT和QbD倡议的基础上,FDA最近推出了新的倡议,以帮助加速采用和实施新的制药技术。药物评价和研究中心通过新兴技术团队(ETT)鼓励和支持新兴技术的开发和采用。ETT是一个小型的、跨职能的团队,其代表来自相关的评估、检查和政策项目,以跟上该领域技术进步的步伐。ETT通过提供早期参与,支持质量评估团队审查提交(包括生物许可申请),促进包括PAT和持续生产在内的新兴技术的实施,并指导解决科学和政策问题。2015年,欧洲启动了一个类似的项目:欧盟创新网络(EU Innovation Network)。该网络包括欧洲药品管理局(EMA)创新工作组和每个欧盟成员国的创新办公室。该网络具有科学、法律和监管能力,旨在鼓励就产品开发的创新方面进行早期对话,包括申请人、学者和研究人员。尽管有这些项目,但很明显,有必要让全球的监管机构跟上新技术的发展,以帮助评估使用复杂技术的应用。这是监管机构、学术界和行业共同面临的挑战。
问题2:不同产品开发阶段实施连续生产工艺的考虑?
从监管角度出发,连续化生产(CM)可以在IND之前,开发期间和上市之后实施,这些对于CM开发都是可以接受的,从科学和监管的角度来看,实施CM最简单的一点可能是在IND之前,通过这种形式,CM可以从小规模开始,并随着开发的进行而扩大规模(可以非常迅速的使用CM应用于试验工厂开发或者前期临床样品的提供。)ETT可参与到开发过程中。
问题3:是否有连续化生物工艺的商业化案例?
关于连续化生物工艺在提高产品质量,开发速度及灵活性方面的技术潜力有很多文章,然而如果连续化生物工艺并没有明确的带来成本上的优势,它将不会被广泛采用,目前生物制造的传统经济驱动力正处在不断变化的状态,生物仿制药的新时代带来了潜在的价格竞争。创新药物开发的重点是加速上市和回收研发成本,而生物仿制药开发的重点是使每单位产品的成本最小化,传统是通过提高细胞培养滴度来实现的,然而,一些单抗细胞培养滴度目前正接近溶解度和基于批次工艺的极限,限制了滴度显著提升的潜力。此外许多现有生物制药设施的老化和更本地化的生产制造推动了简化的设备设施设计和降低资本投资。
最近在一个集成的连续生物工艺平台的经济模型方面的结果表明,在过去十年内,与传统的批次过程相比,连续化生物工艺可以降低55%的平均成本。该模型同时考虑了资本及运行成本,该模型还预测在产品需求超出预期的情况下,成本减少会进一步增加25%,最近的其他工作研究了从临床前到商业化生产的单抗整个生命周期实施连续生物工艺的经济可行性,该研究表明,在商业化生产前的开发过程早期阶段(如临床前、临床阶段),连续生物工艺策略与批次策略相比,在单抗每克直接成本方面具有优势。因此,商业驱动因素和技术能力似乎正在结合在一起,使一体化的连续生物工艺在经济上具有可行性和优势。
3 上游生物工艺进展

灌流工艺不止适用于生产反应器,在种子反应器中同样可以进行灌流培养,达到100M以上的细胞密度;灌流工艺依赖于细胞截留装置,包括过滤,离心,重力沉降。最近最广泛使用的细胞保留方法是 ATF。在实验室和商业化生产规模上,细胞截留装置的考虑因素包括易于安装、维护和操作;长期培养的稳定性;对细胞碎片、大分子、代谢废物和目标产物的透过性;以及对细胞生长和生产效率的不利影响。
PAT通过实时监控和过程控制,促进具有预定义质量属性的产品的持续生成。cqa是确保所需产品的属性,新型的在线、在线和在线采样技术,特别是使用光谱传感器,已经被用于生物工艺过程监控。拉曼散射不同于近红外或红外吸收,通常可以提供关于化学组成和分子结构的互补信息。细胞培养过程中的拉曼光谱已被用于分析复杂的细胞培养基溶液。拉曼光谱在生物制药领域的一个非常吸引人的特点是能够监测蛋白质的结构/化学变化。例如可以在线测量关键质量属性:糖型(唾液酸化)。未来的挑战将是改进传感器设计,以便更容易地将其整合进连续生物工艺过程中,包括实施光谱技术,非浸入式过程监控,并将先进的传感器纳入自动化过程控制策略。新的传感器可能需要进行冗余设计,并可实现过程中重新校准,以解决传感器故障和/或信号漂移问题,满足过程中更换的需要。
4 下游生物工艺进展

与生物制药中的上游连续工艺相比,连续的下游工艺在已上市生物药品的生产中并不常见。通常,细胞培养后的抗体纯化包括三个步骤的批处理模式层析过程:亲和(捕获)和两个离子交换步骤。除了这三个步骤,浓缩/缓冲置换步骤和除病毒可以合并。
使用多个层析柱的各种连续捕获技术已经被开发出来,以允许连续上样到柱饱和点而不产生产品损失。生物制药行业的连续纯化已经从六柱SMB层析、四柱序列层析(sequential multicolumn chromatography,SMCC)发展至三柱PCC层析和柱双柱层析,这些不同的方法各有优点和缺点。需要找到产量、载量利用率和生产效率之间的平衡,最佳工艺将取决于包括操作条件在内的一系列因素,而且可能是针对产品的特定工艺。随着生物反应器抗体滴度的提高,最终的工艺解决方案是连续纯化工艺。在低滴度条件下,单柱连续纯化的循环间歇操作具有较好的产率。然而,当滴度增加超过2 g/L时,多柱连续色谱技术在生产效率和缓冲液使用方面变得更有优势。连续流层析及用于抗体分离的新进展 (xml-data.cn)
PAT在生物下游工艺中的应用受到一定的限制:下游工艺和设备缺乏传感器选择。仅提供pH值、电导率、吸光度、温度和压力传感器的系统实际上并不能测量生物大分子的关键质量属性:产品特性(浓度、纯度等)、杂质(宿主细胞蛋白、DNA、内毒素等)、异构体(错误折叠等)、工艺相关杂质(亲和层析proteinA)。因此,PAT的实施可以成为一体化连续生物工艺中下游操作过程改进的驱动因素,其中一种方式是多波长紫外光谱,在确定蛋白质混合物中的单个蛋白组分是有效的;第二种方式是在层析步骤洗脱液流出时使用在线监测系统:高效液相色谱(HPLC)、荧光和圆二色法已被用于监测过程中CQA。
5 上下游工艺的一体化整合

将上游工艺过程和下游工艺即时捕获进行整合的挑战在于:上游灌流速率和下游纯化速度的同步性问题,如果没有同步,则需要额外储罐,导致整个过程非连续,因此通常需要多柱层析或膜层析。如果在工艺步骤中出现滤器堵塞等情况,工艺过程的同步性也很容易中断,可以在整个过程中加入备用Tank等冗余设备解决。
上游工艺是在无菌条件下进行的。然而,许多类型的下游设备并没有无菌要求。对于一体化连续工艺,需要在上游和下游系统之间进行无菌保障:安装过滤器。然而,由于连续工艺过程可能运行数周到数月,非无菌操作可能需要额外的监测,以确保没有污染。此外,上游和下游系统历来是独立开发的。因此,缺乏同步控制系统。这意味着上游的偏差通常不会被下游系统检测到(即前馈控制),反之亦然(即反馈控制)。由于许多上游参数(如宿主细胞蛋白)会影响下游操作(如纯化),因此需要开发这种整合的控制系统。
上下游端到端工艺需要一个完全封闭的系统,在这个系统中,设备的操作不会使工艺流体暴露在生产环境中。实现真正的封闭系统,需要广泛采用具有标准化进口和出口的一次性系统,以方便无菌连接:例如无菌焊接。实现端到端封闭系统将需要在封闭容器(如可焊接袋)中生成一个工作细胞库,以及在层析系统和过滤单元的进口和出口使用可焊接的一次性使用管路。尽管封闭系统的实现具有挑战性和昂贵的成本,但其将减少污染的风险,并减少清洗和验证时间。这种一次性系统还可能在开发稳健的的过程监测工具和可浸出物/可提取物的控制方面带来新的挑战。
一体化的连续生物工艺的一个重要操作优势是能够在保持灵活性的同时显著减少设备设施的规模。为了充分利用连续工艺对空间需求减少优势,生物反应器操作可以与连续的培养基制备生产线以及连续的下游纯化单元进行空间整合,使用一次性系统和完全封闭的端到端操作提供了灵活性,允许多产品生产能力,同时最大限度地减少交叉污染的风险,否则,使用大型容器配制培养基和/或储存是不可避免的。
生物技术产品的连续生产工艺方法已经存在,在整合连续生物工艺的上下游和一次性使用系统方面有非常多重要的进展,然而,对于推进该领域的进一步发展,仍有一些因素待解决(见问题1-3)。硬件和软件的整合:包含来自不同供应商组件的单元操作一同运行,并以即插即用的方式进行通信。为小分子药物和化学工业开发的现成连续单元操作并不直接适用于生物制药工艺,虽然多柱循环操作是目前连续工艺中流行的一种方法,但它可能最准确地归类为半连续操作。真正的连续分离纯化技术,需要具有足够的分辨率,推进生物制药下游工艺的一体化整合(例如,连续捕获,精纯)。
PAT是QbD的一种基本技术,特别是对于连续工艺过程而言。目前可在生产过程中使用的PAT主要集中于产品质量的间接测量或离线直接测量,这限制了工艺过程的控制水平,并且通常需要对关键过程参数(CPP)和CQA之间的关系进行复杂的理解。显然,先进的PAT技术有潜力解决包括在工艺过程和产品放行时对CQA进行直接和实时检测的问题,甚至可能实现实时放行检测。随着这些进步的发展,确保生物技术产品质量的科学方法也在不断发展。由于以上存在的问题,完全连续的、商业化的、端到端的生物工艺过程尚不容易实现,但根据对专利文献中可能实现的技术的回顾,在未来5到10年内可能会得以实现。精心设计和强化的工艺流程以提供高质量的药物,是生物制药行业的未来:一种对行业和患者都有利的生产模式。
本文来源于亚先知
邵丽竹
何发
相关推荐
-
连续生产推动行业变革
高效、高质、低成本的连续生产将是未来制药行业生产的新模式——GEA作为连续制造技术的领导者,一直致力于在全球范围推动连续制造解决方案的发展。近期,GEA在中国首发了连续湿法制粒机ConsiGma® GD25/80,并宣布在2022年初,使用连续化生产技术的第一条生产线ConsiGma® CDC50将落地中国制药企业,或将给中国制药行业带来巨大变革。
2022-03-05 本刊记者/许飞
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略














评论
加载更多