PROTAC与蛋白降解:机遇和挑战 | 年度盘点

明年1月10日,Arvinas首席执行官John Houston博士将在第十届药明康德全球论坛上携手多位重磅嘉宾,探讨PROTAC等创新分子类型将如何带来颠覆性的疗法,造福全球病患。点击文末“阅读原文/Read More”即可申请观看直播。今天,我们则将结合《自然-生物技术》上周发表的一篇最新文章,谈一谈PROTAC等蛋白降解技术在未来的机遇和挑战。
从诺奖技术到创新疗法
以PROTAC为代表的蛋白降解技术,使用的是细胞内天然的“回收系统”。具体来说,这套系统叫做“泛素介导的蛋白降解系统”,指细胞将不需要的蛋白打上“泛素”标签,然后将它们送到细胞内的蛋白酶体处进行降解。降解后的产物,则能被细胞重新利用。2004年,发现这一系统的三名科学家也荣获诺贝尔化学奖。

有趣的是,当年诺贝尔化学奖的新闻稿里颇有前瞻性地指出,基于这一系统开发的药物有望摧毁不想要的蛋白,从而治疗多种疾病。这恰是PROTAC等蛋白降解技术的理论依据。以PROTAC技术为例,新药研发人员会设计一类具有双特异性的分子,一端结合想要摧毁的致病蛋白,另一端则结合在蛋白降解过程中起到重要作用的E3连接酶,两者通过一个连接子相连。理论上,这种新型的分子能把E3连接酶“拉到”目标致病蛋白附近,并给它们加上泛素,促使细胞降解掉这些蛋白,治疗疾病。
2001年,耶鲁大学的Craig Crews教授与加州理工学院的Ray Deshaies教授联手发表了一篇具有里程碑意义的论文——他们设计出了首个具有功能性的PROTAC分子,并成功对目标蛋白进行降解,完成概念验证。然而这个分子用于结合E3连接酶的部分是一种多肽,这极大限制了其应用。
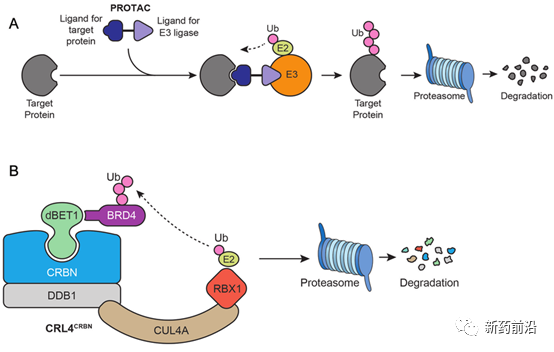
14年后,风云突变。2015年,Crews教授课题组先是连发数篇论文,报道了极具潜力的PROTAC小分子;随即当时还在丹娜·法伯癌症研究所的Jay Bradner教授在《科学》杂志发文,介绍了另一种具有选择性的PROTAC分子。这些论文中提到的机制已经在其它药物中得到过验证,因此迅速吸引了新药研发人员们的关注。“整个领域炸开了锅。” Crews教授说道。
在蛋白降解疗法领域取得爆炸式发展的数年前,Crews教授就富有前瞻性地创办了一家名为Arvinas的公司,加速推进这一技术的科学转化。该公司率先进入临床阶段的两款在研疗法,针对的蛋白靶点分别是雄激素受体和雌激素受体。这是两个非常成熟的靶点,只要能进行降解,就能给患者们带来临床上的收益。如今,Arvinas的相应在研疗法已经取得了非常具有前景的临床数据,也让产业对蛋白降解领域充满期待。
PROTAC技术存在的挑战
表面上看起来清晰易懂的作用机理,在实际研发中则没有那么简单。正如所有新兴的技术那样,PROTAC技术也存在一些挑战。这篇《自然-生物技术》的文章指出,能将E3连接酶“拉到”目标蛋白附近,并不确保后者就能被降解。实际情况中,不同分子之间先要形成一个稳定的三元结构,还要确保能顺利进行泛素化。此外,就算蛋白被成功泛素化,也不代表它们就一定能被顺利降解。
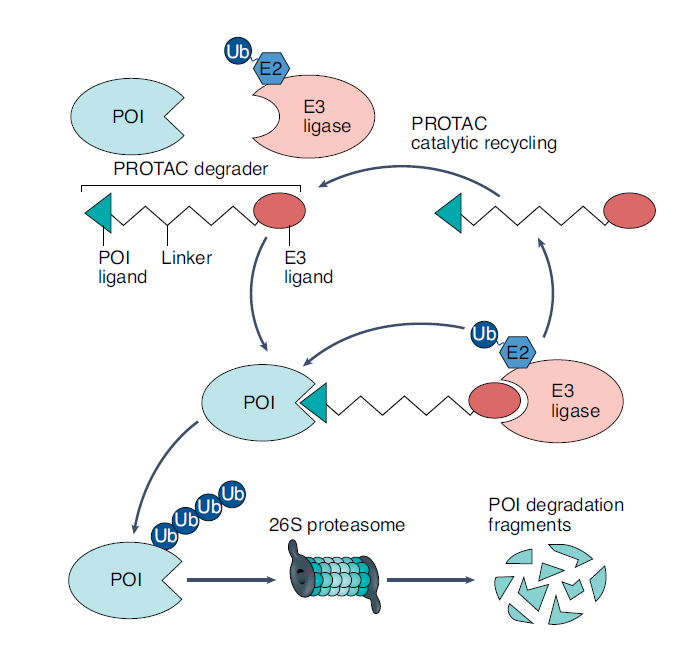
▲PROTAC技术的作用机理(图片来源:参考资料[1])
这是因为蛋白降解疗法和传统的蛋白抑制剂有着很大的区别——与目标蛋白的结合亲和力,并不能用来预测其蛋白降解活性。从这点看,要发现PROTAC的新药分子,很大程度上只能凭借新药研发人员们的经验,有着极高的时间和人力成本。
PROTAC分子在研发上存在的另一个挑战,是确保此类药物的口服生物可利用性(orally bioavailable)。美国密西根大学的蛋白降解专家王少萌教授在文章中指出,PROTAC分子的分子量在0.7到1.1 kDa左右,相较传统小分子而言,表面的极性区域更大。这些都会影响到分子的穿透性。而且与小鼠模型相比,这些分子在人类中的口服生物可利用性更低。而小鼠模型无法用来预测人类中的结果,也进一步增加了新药发现的复杂度。
此外,该文章还指出,PROTAC分子开发的一个瓶颈在于对E3连接酶的选择。在人类中,约有600余种不同的E3连接酶。但大部分正在开发口服蛋白降解剂的公司,专注的都是基于cereblon蛋白的E3连接酶系统。一方面,这是因为相关的研究已经比较纯熟,相关的分子更小、更灵活、也更具可成药性;另一方面,也是因为其它的一些选择总体上更为复杂,容易带来意想不到的后果。目前,这自然是一个可行的开拓性策略。但长远来看,我们还需要找到cereblon之外的作用对象——在某些特定的组织中,可能其它E3连接酶更具活性。
文章中同样提到了PROTAC技术存在的其它一些挑战,比如其能降解的蛋白类型相对比较有限,对于在细胞质侧暴露较少的膜蛋白,可能难以找到结合的位点,也很难给它加上泛素标签。另外,如果一种蛋白具有很多重复序列,或是发生聚合,也会让人难以进行药物的设计。当然,和其它药物分子一样,新药研发人员们还需要限制其潜在毒性和脱靶效应。
PROTAC及其它蛋白降解技术
当然,新药研发人员们也熟知这些挑战,并在试图找到解决方案。因为如果能突破这些瓶颈,无疑将释放出PROTAC更大的潜力。与传统的蛋白抑制剂相比,PROTAC为代表的蛋白降解技术并不只是让目标蛋白失活而已。很多情况下,蛋白除了自己的生化功能,还具有结构上的支架功能。在这一点上,蛋白降解疗法具有独特的优势。而且理论上说,PROTAC等分子在目标蛋白被降解后,还能从蛋白上解离下来,结合更多靶点。因此,其使用的剂量有望更低。当然,在目前的一些临床试验中,PROTAC分子的这一优势还没完全体现,但它有望在未来成为现实。
我们同样需要了解,蛋白降解技术并不只有PROTAC一种。比如这篇文章中提到,目前不少公司正在开发一类叫做“分子胶”的蛋白降解技术。与PROTAC分子不同,分子胶只结合E3连接酶,改变其表面的形状,从而招募目标蛋白,完成蛋白降解。由新基公司带来的来那度胺(lenalidomide)可被视为分子胶的原型,它能启动cereblon蛋白,降解Ikaros和Aiolos两种转录因子,治疗多发性骨髓瘤。
但与传统新药研发不同,分子胶的开发有点“逆流而上”的意思——它很难先选择一个疾病相关的靶点,再进行药物开发。相反,它往往会先对能结合E3连接酶的分子进行筛选,直至取得想要的特性,再用于蛋白数据库的大规模筛选,寻找可以降解的蛋白靶点。
此外,诸如LYTAC、ATTEC、AUTAC等创新蛋白降解技术也正层出不穷。比如今年与礼来公司达成合作的Lycia Therapeutics,其溶酶体靶向嵌合体(LYTAC)蛋白降解技术能将细胞外蛋白送至溶酶体中进行降解。今年完成3000万美元A轮融资的PAQ Therapeutics开发的自噬体绑定化合物(ATTEC)技术能够将靶点底物与自噬体绑定,导致底物降解。而自噬靶向嵌合体(AUTAC)技术则类似PROTAC,通过自噬反应降解目标蛋白。
今年早些时候,《自然》子刊Nature Reviews Drug Discovery曾撰文指出,今年年底将有至少15款在研蛋白降解疗法进入临床阶段。从年底往回看,这一领域在今年也的确斩获了诸多进展。
“作为一项新兴技术,PROTAC极大拓宽了未来人类进行药物开发在靶点选择上的可能性,”药明康德高级副总裁、药物研发国际服务部负责人郭涛博士曾在今年7月表示,“从2016年这一技术刚刚起步之时,药明康德就开始布局PROTAC相关能力和技术,并积累了大量成功经验。随着近年来对PROTAC了解的逐步深入,公司针对PROTAC分子已搭建了完善的一体化赋能平台,集发现、合成、分析纯化和测试等能力于一体。目前公司HitS事业部正在进一步强化DEL等技术在化合物发现上的优势作用,以帮助更多合作伙伴找到更多优秀的PROTAC分子。”
我们也期待随着科学的进步和技术的发展,蛋白降解疗法可以取得更多突破性的成就,早日造福广大病患!
本文来源于药明康德
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多